Молекулын физик ба термодинамикийн молекулын физик i. Молекулын физик ба термодинамикийн үндэс
МОЛЕКУЛАР ФИЗИК, ТЕРМОДИНАМИКИЙН ҮНДЭСЛЭЛ
Статистик ба судалгааны ажлын аргууд .
Молекулын физик ба термодинамик нь биед агуулагдах асар олон тооны атом ба молекулуудтай холбоотой бие махбод дахь макроскопийн процессыг судалдаг физикийн салбарууд юм.
Молекулын физик нь молекул кинетик ойлголт гэж нэрлэгддэг бодисын бүтэц, шинж чанарыг судалдаг физикийн салбар юм. Эдгээр санаануудын дагуу:
1. Аливаа бие нь хатуу, шингэн эсвэл хийн хэлбэртэй байдаг нь маш олон тооны маш жижиг тусгаарлагдсан тоосонцор-молекулуудаас тогтдог.
2. Аливаа бодисын молекулууд хязгааргүй эмх замбараагүй хөдөлгөөнд ордог (жишээлбэл, Броуны хөдөлгөөн).
3. Тохиромжтой хийн загварыг ашигладаг бөгөөд үүнд:
ба). Хийн молекулуудын дотоод эзэлхүүн нь савны эзэлхүүнтэй харьцуулахад харьцангуй бага байдаг (ховор тохиолддог).
б). Молекулуудын хооронд харилцан үйлчлэх хүч байдаггүй.
-д). Хийн молекулууд хоорондоо ба хөлөг онгоцны ханатай мөргөлдөх нь туйлын уян хатан шинж чанартай байдаг.
4. Биеийн макроскоп шинж чанарыг (даралт, температур г.м.) статистикийн аргыг ашиглан тайлбарласан бөгөөд гол ойлголт нь статистикийн чуулга юм. зан үйлийг тодорхойлдог их тоо бие даасан хэсгүүдийн биш харин бүхэл бүтэн чуулгын дундаж шинж чанарыг (дундаж хурд, энерги) нэвтрүүлэх замаар бөөмс.
Термодинамик нь молекул-кинетик онолоос ялгаатай нь бие махбодийн макроскоп шинж чанарыг судлахгүйгээр тэдгээрийн макроскоп шинж чанарыг судалдаг.
Термодинамик - термодинамикийн тэнцвэрт байдал дахь макроскопын системийн ерөнхий шинж чанар, эдгээр төлөв хоорондын шилжилтийн үйл явцыг судалдаг физикийн салбар.
Термодинамик нь олон тооны туршилтын баримтуудыг нэгтгэн дүгнэхэд үндэслэсэн термодинамикийн зарчмууд гэж нэрлэгддэг 3 үндсэн хууль дээр суурилдаг.
Молекулын кинетик онол ба термодинамик нь бие биенээ нөхөж, нэг бүтэн байдлыг бүрдүүлдэг боловч судалгааны янз бүрийн аргаар ялгаатай байдаг.
Термодинамикийн систем гэдэг нь өөр хоорондоо болон бусад биетэй харилцан үйлчлэлцэж, энерги солилцдог макроскопын цогц юм. Системийн төлөвийг термодинамикийн параметрүүдээр тогтоодог - термодинамик системийн шинж чанарыг тодорхойлдог физик хэмжигдэхүүний багц бөгөөд ихэвчлэн температур, даралт, тодорхой эзэлхүүнийг төлөвийн параметр болгон сонгодог.
Температур - биет хэмжээмакроскопийн системийн термодинамикийн тэнцвэрт байдлыг тодорхойлох.
[T] \u003d K - термодинамикийн хуваарь, [t] \u003d ° C - олон улсын практик цар хүрээ. Термодинамик ба м / н практик температурын хамаарал: T \u003dt + 273, жишээлбэл, t \u003d 20 ° C үед T \u003d 293 K.
Тодорхой хэмжээ нь массын нэгжийн эзэлхүүн юм. Бие нь нэгэн төрлийн байх үед, өөрөөр хэлбэл ρ \u003dconst , дараа нь нэгэн төрлийн биеийн макроскоп шинж чанарууд нь биеийн эзэлхүүнийг тодорхойлж чаддагV.
Идеал хийнүүдийн молекул кинетик онол (m.c.t).
§1 Идеал хийн хууль .
Молекул кинетик онол нь хамгийн тохиромжтой хийн загварыг ашигладаг.
Хамгийн тохиромжтой хий молекулууд нь хоорондоо хол зайд харилцан үйлчлэлцдэггүй, хэмжигдэхүүнгүй хэмжээтэй хий гэж нэрлэдэг.
Бодит хийд молекулууд молекул хоорондын харилцан үйлчлэлийн хүчийг мэдэрдэг. Гэсэн хэдий чH 2, He, O 2, N 2 n үед. үед. (T \u003d 273K, P \u003d 1.01 · 10 5 Pa) -ийг хамгийн тохиромжтой хий гэж тооцож болно.
Параметрүүдийн аль нэгийг (p, V, T, S ) тогтмол хэвээр үлдэхийг изопроцесс гэж нэрлэдэг.
- Изотермийн процесс T \u003d const, m \u003d const тайлбарласан болно бойл-Мариотт:
pV \u003d const
- Изобарикүйл явцp \u003d const тайлбарласан гей Луссакийн тухай хууль
V \u003d V 0 (1+ α t);
V \u003d V 0 α T
Эзлэхүүний өргөтгөлийн коэффициентградус -1

- Исохорик процесс V \u003d const
 Тайлбарласан чарльзын хууль
Тайлбарласан чарльзын хууль
p \u003d p 0 (1+ α t);
p \u003d p 0 α T
Эзлэхүүний температураас хамаарлын шинж чанарыг тодорхойлдог.α нь 1 К-ээр халах үед хийн эзэлхүүний харьцангуй өөрчлөлттэй тэнцүү байна. Туршлагаас харахад бүх хийнүүдийн хувьд ижил бөгөөд тэнцүү байна.
4. Бодисын мэнгэ. Авогадрогийн дугаар. Авогадрогийн хууль.
Атомын масс ( ) химийн элемент гэдэг нь энэ элементийн атомын массын нүүрстөрөгчийн изотопын атомын массын 1/12 харьцаа 12
2.1. Молекулын физик ба термодинамикийн үндсэн ойлголтууд
Молекулын физик - бичил харуурын (молекулын) бүтцэд үндэслэн янз бүрийн нэгдлийн төлөв байдалд байгаа бодисын физик шинж чанар, бүтцийг судалдаг физикийн салбар.
Бодисын бүтцийн молекул кинетик онол Биеийн шинж чанарыг тэдгээрийн молекулын бүтцийн талаархи санаан дээр үндэслэн судалдаг молекул физикийн салбар.
Статистик физик - Молекул физикийн хэсэг, үүнд бие даасан молекулуудын (бөөмсийн) шинж чанар, хөдөлгөөнийг судалж үздэггүй, гэхдээ дундаж утгуудаар тодорхойлогддог бөөмсийн нэгтгэсэн хэсгүүд.
Термодинамик - физик системийн шинж чанарыг бичил харуурын бүтцээс үл хамааран судалдаг шинжлэх ухаан.
Систем - авч үзэж буй биетүүдийн багц (тухайлбал: молекул, атом, бөөмс).
Системийн төлөвийн параметрүүд:p даралт, V эзэлхүүн, T температур.
a) Эрчимжсэн параметрүүд - системийн массаас хамаардаггүй параметрүүд (даралт, температур, концентраци гэх мэт).
Температур - макроскопийн системийн термодинамикийн тэнцвэрийн байдлыг тодорхойлдог физик хэмжигдэхүүн. Температурын шинж чанар нь дулаан солилцооны чиглэлийг тодорхойлох явдал юм. Молекулын физикийн температур нь бөөмсийн энергийн түвшинг хуваарилах, бөөмсийн хурдны тархалтыг тодорхойлдог.
Термодинамикийн температурын хуваарь - температурын хуваарь, тодорхойлогдсон температур (үнэмлэхүй температур), үргэлж эерэг байдаг.
b) Өргөн цар хүрээтэй параметрүүд - параметрүүд (эзэлхүүн, дотоод энерги, энтропи гэх мэт), тэдгээрийн утга нь термодинамик системийн масстай эсвэл түүний эзлэхүүнтэй пропорциональ байна.
Системийн дотоод энерги - молекулуудын эмх замбараагүй хөдөлгөөний нийт кинетик энерги, тэдгээрийн харилцан үйлчлэлийн потенциал энерги ба молекул доторх энерги, кинетик энергийг бүхэлд нь (хөдөлгөөний үед) болон гадаад талбайн боломжит энергийг тооцоогүйгээр системийн энерги.
Системийг төлөвөөс төлөв байдалд шилжүүлэх явцад дотоод энергийн өөрчлөлт нь эдгээр төлөвүүдийн дотоод энергийн утгуудын зөрүүтэй тэнцүү бөгөөд системийн нэг төлөвөөс нөгөө төлөв рүү шилжих замаас хамаардаггүй.
Системийн тэгшитгэл:
F (p, V, T) \u003d 0. (2.1)
Системийн тэнцвэргүй байдал - системийн төлөвийн параметрүүдийн аль нэг нь өөрчлөгдөх болно.
Системийн тэнцвэрт байдал - системийн төлөв байдлын бүх параметрүүд нь тогтмол гадаад нөхцөлд тогтмол байх тодорхой утгатай байх ёстой.
Амралтын цаг - систем тэнцвэрт байдалд орох үе.
Процесс - системийн нэг төлөвөөс нөгөө төлөв рүү шилжих, түүний төлөв байдлын дор хаяж нэг параметр өөрчлөгдсөнтэй холбоотой:
a) буцаах үйл явц - системийн эргэн тойрон дахь орчинд ямар ч өөрчлөлт үлдэхгүй байхын тулд ижил завсрын төлөвүүдээр дамжуулан системийн эцсийн төлөвөөс анхны төлөв рүү урвуу шилжилтийг хийх боломжтой үйл явц;
б) эргэлт буцалтгүй үйл явц - системийн анхны төлөв рүү шилжих шилжилтийг буцаах боломжгүй, эсвэл үйл явцын төгсгөлд хүрээлэн буй орчин эсвэл системд ямар нэгэн өөрчлөлт гарсан бол процесс;
в) дугуй процесс (мөчлөг) - ийм өөрчлөлтийн дараалал, үүний үр дүнд систем нь анхны төлөв байдлаас гарсны дараа дахин эргэж ирдэг. Аливаа дугуй процесс нь тэлэлт ба агшилтын процессоос бүрдэнэ. Өргөтгөх процессыг системийн гүйцэтгэсэн ажил, агшилтын процессыг систем дээр гадны хүчээр гүйцэтгэсэн ажил дагалддаг. Эдгээр бүтээлүүдийн ялгаа нь энэ мөчлөгийн ажилтай тэнцүү байна.
Динамик хэв маяг -тэгшитгэлийн системд дуулгавартай байх (дифференциал, интеграл г.м. орно), анхны нөхцөл тус бүрт нэг шийдэл байгааг хүлээн зөвшөөрөх.
Статистик хэв маяг- тогтоосон тоон хэв маяг статистикийн аргаЗөвхөн тухайн молекулын багцыг тодорхойлох хэмжигдэхүүний дундаж утгыг авч үздэг (тодорхой молекулын загварыг авч үзээд магадлалын онол дээр үндэслэсэн математик статистик аргуудыг хэрэглэнэ).
Термодинамикийн магадлал - макроскоп физик системийн тухайн төлөвийг хэрэгжүүлэх арга замуудын тоо (тодорхой үйл явдлын харьцангуй давтамж нь гадны байнгын нөхцөлд хязгааргүй болох хандлагатай туршилтын хангалттай олон тооны давталтад чиглэгдэх хязгаар):
w \u003d n / N, (2.2)
энд N нь туршилтын тоо;
n - тодорхой үйл явдлыг хэдэн удаа хүлээн авсан тоо.
Хэлбэлзэл- физик хэмжигдэхүүний дунджаас санамсаргүй хазайлт.
Молекул - химийн үндсэн шинж чанартай, химийн холбоогоор холбогдсон атомуудаас бүрдэх бодисын хамгийн жижиг хэсэг.
Атом - шинж чанар бүхий химийн элементийн хамгийн жижиг хэсгүүд болох бичил харуурын хэмжээ (микробөөм) -ийн нэг хэсэг. Өөр өөр хослолууд дахь атомууд нь янз бүрийн бодисын молекулуудын нэг хэсэг юм.
Харьцангуй атомын масс - өгөгдсөн атомын массын 12 (12 С) массын дугаартай нүүрстөрөгчийн изотопын массын 1/12 харьцаа.
Харьцангуй молекул жин гэдэг нь өгөгдсөн молекулын массыг 12 С атомын массын 1/12 харьцаа юм.
Мэнгэ - C 12 нүүрстөрөгчийн изотопын 0.012 кг дахь атомын тоотой тэнцүү тоосонцор (атом, молекул болон бусад хэсгүүд) -ийн тоог агуулсан бодисын хэмжээ.
Авогадрогийн дугаар - аливаа бодисын мэнгэ дэх атом буюу молекулын тоо: N A \u003d 6.0210 23 моль -1.
Моляр масс - нэг мэнгэ хэмжээгээр авсан бодисын масс:
\u003d m 0 N A. (2.3)
2.2. Молекул кинетикийн онолын үндсэн ойлголт ба хууль
Хамгийн тохиромжтой хий - хийн хэсгүүдийн харилцан үйлчлэлийг тооцдоггүй онолын загвар (бөөмсийн дундаж кинетик энерги нь тэдгээрийн харилцан үйлчлэлийн энергиэс хамаагүй их байдаг). Хамгийн тохиромжтой хийн молекулуудын хэмжээ нь тэдгээрийн хоорондын зайтай харьцуулахад бага байдаг. Ийм хийн молекулуудын дотоод эзэлхүүн нь савны эзэлхүүнтэй харьцуулахад бага байдаг. Молекулуудын харилцан үйлчлэлийн хүч маш бага тул мөргөлдөөнөөс мөргөлдөөн хүртэлх молекулын хөдөлгөөн шулуун шугаман сегментийн дагуу явагдана. Молекулуудын нэг секундэд мөргөлдөх тоо их байдаг.
Идеал хийн молекул кинетик онолын үндсэн заалтууд:
1) хий нь хамгийн жижиг хэсгүүдээс тогтдог - тасралтгүй хөдөлгөөнтэй атомууд эсвэл молекулууд;
2) молекул кинетикийн онолын дүгнэлтийг хэрэгжүүлэх боломжтой маш бага хэмжээтэй бол молекулын тоо маш их байна;
3) молекулуудын хэмжээ нь тэдгээрийн хоорондын зайтай харьцуулахад бага байдаг;
4) хийн молекулууд өөр хоорондоо эсвэл түүний байрлаж буй савны ханатай дараалсан хоёр харилцан үйлчлэлийн хооронд чөлөөтэй хөдөлдөг. Мөргөлдөөний моментоос бусад тохиолдолд молекулуудын харилцан үйлчлэлийн хүч нь ач холбогдолгүй юм. Молекулуудын мөргөлдөөн нь механик энерги алдагдалгүйгээр явагддаг. туйлын уян хатан харилцан үйлчлэлийн хуулийн дагуу;
5) гадны хүч байхгүй тохиолдолд хийн молекулууд эзэлхүүн даяар жигд тархдаг;
Хийн молекул кинетик онолын үндсэн тэгшитгэл:
хаана  дундаж квадрат хурд юм.
дундаж квадрат хурд юм.
Даралтын хийнүүдийн молекул кинетик онолын үндсэн тэгшитгэл:
 ,
,
 , (2.5)
, (2.5)
энд n 0 \u003d N "/ V - нэгж эзэлхүүн дэх молекулын тоо;
 - хийн молекулуудын шилжих хөдөлгөөний дундаж кинетик энерги;
- хийн молекулуудын шилжих хөдөлгөөний дундаж кинетик энерги;
k бол Больцманы тогтмол байдаг.
Авогадрогийн хууль: ижил температур, даралттай ижил хэмжээ нь ижил тооны молекул агуулдаг.
Далтоны хууль: хийн хольцын даралт нь хэсэгчилсэн даралтын нийлбэртэй тэнцүү, өөрөөр хэлбэл. Хэрэв хольцын эзэлхүүн дэх эзэлхүүн дотор цорын ганц нэг нь байвал хольцонд орж буй хий тус бүр дээр дарагдах болно.
Дурын массын хувьд хамгийн тохиромжтой хийн төлөвийн тэгшитгэлм (Менделев-Клапейрон тэгшитгэл):
 ,
(2.7)
,
(2.7)
энд R нь тогтмол даралтын дор нэг градусаар халаахад нэг молийн хийн өргөтгөлийн ажилтай тоон хувьд тэнцүү байдаг хийн тогтмол;
T нь үнэмлэхүй температур юм.
Эрх чөлөөний зэрэгi нь системийн орон зайг бүрэн тайлбарлахад шаардагдах бие даасан координатын тоо юм. Бүх эрх чөлөөний зэрэг тэгш байна.
Нийт эрх чөлөөний зэрэг
 (2.8)
(2.8)
хаана  - орчуулгын хөдөлгөөний эрх чөлөөний зэрэг;
- орчуулгын хөдөлгөөний эрх чөлөөний зэрэг;
 - эргэлтийн хөдөлгөөний чөлөөт байдлын тоо;
- эргэлтийн хөдөлгөөний чөлөөт байдлын тоо;
 - хэлбэлзлийн хөдөлгөөний эрх чөлөөний зэрэг;
- хэлбэлзлийн хөдөлгөөний эрх чөлөөний зэрэг;
i kp - орчуулгын хөдөлгөөн дэх цэгийн чичиргээний чөлөөт байдлын зэрэг;
i kvr - эргэлтийн хөдөлгөөний үед цэгийн чичиргээний чөлөөт байдлын зэрэг.
Хийн молекулууд хэд хэдэн эрх чөлөөний зэрэгтэй байдаг.
а) монатомик - i \u003d 3 (орчуулгын хөдөлгөөний гурван эрх чөлөөний зэрэг);
б) атомуудын хоорондох уян холбоос бүхий диатомик - i \u003d 6;
в) атомуудын хооронд хатуу холбоо бүхий диатомик - i \u003d 5;
d) атомуудын хооронд хатуу холбоо бүхий гурван атомын молекул - i \u003d 6.
Эрчим хүчний эрх чөлөөний зэргээр жигд хуваарилагдах теорем: ямар ч эрх чөлөөний зэрэг нь дунджаар ижил энерги, тэнцүү байна  ба i эрх чөлөөний зэрэгтэй молекул нь энергитэй байдаг
ба i эрх чөлөөний зэрэгтэй молекул нь энергитэй байдаг
 (2.9)
(2.9)
энд i \u003d i p + i bp + i k.
Хийн дурын массын дотоод энергим бие даасан молекулуудын энергиэс бүрдэнэ.
 ,
(2.10)
,
(2.10)
нь хийн молийн масс юм.
Дулааны багтаамж - бодисыг нэг градусаар халаахын тулд мэдээлэх ёстой дулааны хэмжээтэй тэнцүү биет хэмжээ.
Тодорхой дулаан "в" - нэг хэмээр халаахын тулд бодисын нэгж масст мэдээлэх ёстой дулааны хэмжээтэй тэнцүү тооны физик хэмжигдэхүүн.
Молийн дулааны багтаамж "C" - температурыг нэг градусаар нэмэгдүүлэхийн тулд нэг моль бодисын биед хүргэх ёстой дулааны хэмжээтэй тэнцүү биет хэмжээ:
 .
(2.11)
.
(2.11)
Тогтмол эзлэхүүн дэх тодорхой дулаан "в v " - тогтмол эзэлхүүний нөхцөлд нэг градусаар халаахын тулд бодисын нэгж жинд мэдээлэх ёстой дулааны хэмжээтэй тэнцүү хэмжээний физик хэмжигдэхүүн:
 (2.12)
(2.12)
Тогтмол даралтын тодорхой дулаан "в х " - Байнгын даралтын дор нэг хэмээр халаахын тулд бодисын нэгж масст мэдээлэх ёстой дулааны хэмжээтэй тэнцэх физик хэмжигдэхүүн:
 .
(2.13)
.
(2.13)
Тогтмол эзэлхүүн дэх молийн дулааны багтаамж "C v " - тогтмол эзэлхүүний нөхцөлд түүний температурыг нэг градусаар нэмэгдүүлэхийн тулд нэг моль бодисын биед өгөх ёстой дулааны хэмжээтэй тэнцүү биет хэмжээ:
 .
.
 .
(2.14)
.
(2.14)
Тогтмол даралттай молийн дулааны багтаамж "C х " - тогтмол даралтын дор температурыг нэг градусаар нэмэгдүүлэхийн тулд нэг моль бодисыг дамжуулах ёстой дулааны хэмжээтэй тэнцэх физик хэмжигдэхүүн:
 ,
,
 .
(2.15)
.
(2.15)
Молийн ба хувийн дулааны багтаамжийн харьцаа :
Молекулуудын дундаж квадрат хурд ("m" масстай хийн хувьд T \u003d const) тэнцвэрт байдалд тогтмол хэвээр байна:
 эсвэл
эсвэл  , (2.17)
, (2.17)
энд N i нь v i хурдтай молекулын тоо;
N нь бүх молекулуудын тоо юм.
Магадгүй хурд - Максвелл тархалтын функцын хамгийн их байрлалыг тодорхойлдог молекулуудын хөдөлгөөний хурд:
 (2.18)
(2.18)
Арифметикийн дундаж хурд
 (2.19)
(2.19)
Харьцангуй хурд v-ээс v + dv хүртэлх хурдаар хөдөлж буй молекулуудын тоог тооцоолоход ашигладаг.
u \u003d v / v c. (2.20)
Тохиромжтой хийн молекулуудыг хөдөлгөөнгүй байдалд хурдаар хуваарилах хууль (Максвелл тархалт):
 (2.21)
(2.21)
dn v нь v-ээс v + dv хооронд хэлбэлздэг нэгж эзэлхүүн дэх молекулын дундаж тоо;
n нь нэгж эзэлхүүн дэх молекулын тоо юм.
Түгээх функц (тэдгээрийн нийт тооноос молекулуудын эзлэх хувийг тодорхой хурдны хязгаарт хамааруулна):
 эсвэл
эсвэл  ,
(2.22)
,
(2.22)
dn v / ndv бол түгээх функц юм.
Молекулын чөлөөт урсгал - дараалсан хоёр мөргөлдөөний хоорондох молекулаар туулсан траекторийн шулуун хэсгүүд.
Молекулын дундаж чөлөөт зам Хоёр мөргөлдөөний хоорондох молекулын туулсан дундаж зай юу:
 (2.23)
(2.23)
энд Z нь мөргөлдсөн тоо;
v нь молекулын дундаж хурд;
k бол Больцманы тогтмол;
d нь молекулын диаметр;
p - даралт;
T нь үнэмлэхүй температур юм.
Мөргөлдөөний дундаж тоо - молекулуудын мөргөлдөөний тоо
 ,
(2.24)
,
(2.24)
Үр дүнтэй молекулын диаметрd нь 2 молекулын төвүүд хоорондоо мөргөлдөхөд ойртох хамгийн бага зай юм.
Үр дүнтэй хэсэг - утга тэнцүү
\u003d d 2. (2.25)
Барометрийн томъёодаралт нь өндрөөр буурч, хий нь илүү хүнд болж, температур нь буурч байгааг харуулж байна.
(2.26)
Хийн молекулын таталцлын хүчний талбайн өндөрт тархах хууль (Больцманы тархалт):
n o - молекулуудын потенциал энерги тэг байх газар дахь нэгж эзэлхүүн дэх молекулын тоо;
n нь молекулуудын потенциал энерги W p байх орон зайд байгаа нэгж эзэлхүүн дэх молекулын тоо юм.
Максвелл-Больцманы тархалт - Энэхүү тархалтын ачаар v-ээс v + dv хүртэлх хурдтай, гадны хүчний талбарт \u003d gh потенциалтай идеал хийн молекулуудын фракцийг тодорхойлох боломжтой.
 ,
(2.28)
,
(2.28)
хаана v in - хамгийн их магадлалтай хурд, түүний утга нь Максвелл муруйн хамгийн их утгатай тохирч байна.
Хийн нягт ба өндөр:
энд m o нь нэг молекулын масс юм.
2.3. Термодинамикийн үндэс ба хууль
Термодинамикийн анхны хууль - термодинамик процесст дагалддаг энергийг хадгалах, өөрчлөх хууль - системд нийлүүлсэн дулааны хэмжээ нь түүний дотоод энерги болон системийн гадны хүчний эсрэг хийсэн ажлыг өөрчлөхөд зориулагдана.
 , (2.30)
, (2.30)
dU нь системийн дотоод энергийн өөрчлөлт;
Q нь системд нийлүүлдэг дулааны үндсэн хэмжээ;
A - системийн гүйцэтгэдэг анхан шатны ажил.
Изотермийн процесс - тогтмол температурт явагдах процесс (T \u003d const). Изотермийн процесст системд нийлүүлсэн бүх дулааныг энэ системийн гүйцэтгэлд зарцуулдаг.  ба dU \u003d C v dT \u003d 0,
ба dU \u003d C v dT \u003d 0,
ба U \u003d \u003d const.
м изотермийн процесст хамгийн тохиромжтой хий:
 .
(2.31)
.
(2.31)
Изобарик процесс - тогтмол даралттай явагдах процесс (p \u003d const). Энэ тохиолдолд системд нийлүүлсэн дулаан нь дотоод энергээ өөрчлөх, энэ системийн ажлыг гүйцэтгэхэд аль алинд нь зарцуулагдана.
Дурын массаар хийсэн ажил м
 . (2.33)
. (2.33)
Дурын массын дотоод энергийн өөрчлөлт м изобарийн процесст хамгийн тохиромжтой хий:
 .
(2.34)
.
(2.34)
Исохорик процесс - тогтмол эзлэхүүн дээр явагдах процесс (V \u003d const). Энэ тохиолдолд системд нийлүүлсэн бүх дулаан нь дотоод энергийг өөрчлөхөд чиглэгддэг.
 ,
,
 (2.35)
(2.35)
Адиабатик үйл явц - дулаан солилцоогүй эсвэл хүрээлэн буй орчинтой бараг дулаан солилцоогүй явагдах процесс. Энэ тохиолдолд системийг зөвхөн дотоод энерги алдагдсанаас болж гүйцэтгэж болно.
 ,
,
 .
(2.36)
.
(2.36)
Адиабат процессын тэгшитгэл (Пуассоны тэгшитгэл):

 ;
;
 . (2.37)
. (2.37)
Дурын массаар хийсэн ажил м адиабатик тэлэлтэд хамгийн тохиромжтой хий:
 .
(2.38)
.
(2.38)
Политроп үйл явц - p ба V харьцаатай холбоотой үйл явц:
 , (2.39)
, (2.39)
энд n нь политропик үзүүлэлт бөгөөд - -ээс + хүртэлх утгыг авна. Тодруулбал, изобарийн процессын хувьд n \u003d 0, изотермаль - n \u003d 1, адиабатик - n \u003d , изохорик - n \u003d .
Дурын массаар хийсэн ажил м политропийн процесст хамгийн тохиромжтой хий:
 (2.40)
(2.40)
Дугуй процесст хамгийн тохиромжтой хий хийдэг ажил нь А 1 өргөтгөл ба хийн 2 шахах үеийн ажлын хоорондох зөрүүтэй тэнцүү бөгөөд Q 1 өргөтгөлийн үед системд нийлүүлсэн дулааны Q 2 шахалтын үед түүнээс гарсан дулааны зөрүүтэй тэнцүү байна. :
Дугуй үйл явцын үр ашиг (мөчлөг) -системд нийлүүлсэн дулааныг бүхэлд нь хөрвүүлэхэд мөчлөгийн ажлын харьцаа ба физик хэмжигдэхүүн:
 (2.42)
(2.42)
Карногийн мөчлөг - хоёр изотерм ба хоёр адиабат процессоос бүрдэх мөчлөг.
Дурын массаар хийсэн ажил м Карногийн мөчлөг дэх хамгийн тохиромжтой хий, - өргөжүүлэх үед системийн хийсэн ажил болон шахсан үед систем дээр хийсэн ажлын хоорондох ялгаа:
 .
(2.43)
.
(2.43)
Карногийн мөчлөгийн үр ашиг нь тухайн бодисын шинж чанараас хамаардаггүй бөгөөд зөвхөн системд дулааныг өгч, түүнээс авах температураас хамаарна.
 .
(2.44)
.
(2.44)
Хөргөлтийн машин (хөргөгч) -ийн үр ашиг:
 (2.45)
(2.45)
Оттогийн мөчлөг нь хоёр адиабат ба хоёр изохороос бүрдэнэ.
Дизель цикл изохор ба изобар гэсэн хоёр адиабатаас бүрдэнэ.
Энтропи гэдэг нь системийн нэг төлөвөөс нөгөөд шилжих үеийн элементийн өөрчлөлт нь хүлээн авсан буюу өгөгдсөн дулааны хэмжээг энэ процесс явагдсан температурт хуваасантай тэнцүү физик хэмжигдэхүүн юм.
 .
(2.46)
.
(2.46)
Системийн энтропи ба термодинамикийн магадлалын хоорондын хамаарал (Больцманы харилцаа):
S \u003d kln w, (2.47)
энд k бол Больцманы тогтмол юм.
нэг төлөвөөс нөгөө төлөв рүү шилжих
 .
(2.48)
.
(2.48)
Системийн энтропийн өөрчлөлт нэг төлөвөөс нөгөө төлөв рүү шилжих:
Системийн энтропийн өөрчлөлт изотермийн процесс:
 . (2.50)
. (2.50)
Системийн энтропийн өөрчлөлт изобарийн процесс:
Системийн энтропийн өөрчлөлт изохорик процесс:
 .
(2.52)
.
(2.52)
Системийн энтропийн өөрчлөлт адиабат процесс:
S \u003d 0,  .
(2.53)
.
(2.53)
Карногийн мөчлөгийг гүйцэтгэдэг системийн энтропийн өөрчлөлт:
 ,
(2.54)
,
(2.54)
S p нь ажлын шингэний энтропийн өөрчлөлт;
S n, S x - халаагч ба хөргөгчний энтропийн өөрчлөлт;
S pr - "ажлын хэрэглэгч" -ийн энтропийн өөрчлөлт.
Хэрэв систем нь Карногийн эргэлт буцалтгүй эргэлт хийвэл хаалттай системийн энтропи өөрчлөгдөхгүй:
S arr \u003d 0 эсвэл S arr \u003d const. (2.55)
Хэрэв систем Карногийн эргэлт буцалтгүй мөчлөг хийвэл хаалттай системийн энтропи нэмэгддэг:
S 0;  ;
;
 .
(2.56)
.
(2.56)
Хаалттай системд тохиолдох дурын процессын хувьд системийн аливаа үйл явцын энтропи буурч чадахгүй:
S 0 эсвэл  , (2.57)
, (2.57)
тэнцүү тэмдэг нь буцаагдах процессуудад, тэгш бус байдлын тэмдэг нь эргэлт буцалтгүй процесст хүчинтэй.
Термодинамикийн хоёрдахь хууль: Тусгаарлагдсан системд зөвхөн системийн энтропи нэмэгдэх эсвэл процесс боломжгүй болох ийм процессууд л боломжтой байдаг бөгөөд цорын ганц үр дүн нь халаагчаас авсан дулааныг ажил болгон хувиргах явдал юм.
Термодинамикийн потенциал - V эзэлхүүний тодорхой функцууд, даралт p, температур T, энтропи S, систем дэх хэсгүүдийн тоо N ба бусад термодинамик системийн төлөв байдлыг тодорхойлдог бусад макроскоп параметрүүд:
a) дотоод энерги - системийн дотоод төлөв байдлаас хамаарч энерги. Энэ төлөвийг тодорхойлдог бие даасан хувьсагчдын хоёрдмол утгагүй функц, жишээлбэл, температур T ба эзэлхүүн V (эсвэл даралт p):
U \u003d U (S, V, N, x). (2.59)
Системийн дотоод энергийг өөрчлөх У зөвхөн эхний ба эцсийн муж дахь утгуудаар тодорхойлогддог:
 .
(2.60)
.
(2.60)
б) энтальпи (дулааны агууламж) энтропи S ба p даралтыг үндсэн бие даасан хувьсагч болгон сонгоход термодинамикийн тэнцвэрт байдал дахь макроскопын системийн төлөв байдлыг тодорхойлдог.
H \u003d H (S, p, N, x). (2.61)
Системийн үрэвсэл түүний бүрэлдэхүүн хэсгүүдийн энтальпийн нийлбэртэй тэнцүү байна.
Энтальпи ба дотоод энергийн хоорондын холбоо У систем:
 ,
(2.62)
,
(2.62)
энд V нь системийн эзлэхүүн юм.
Нийт энтальпийн дифференциал (өөрчлөгдөөгүй үед Н болон х ) хэлбэртэй байна
 .
(2.63)
.
(2.63)
Системийн температур, эзэлхүүн ба дулаан багтаамжтай энтальпийн хамаарал:
 ;
;
 ; C p \u003d (dH / dt). (2.64)
; C p \u003d (dH / dt). (2.64)
Энтальпийн өөрчлөлт ( H) нь тогтмол даралтын дор системд дамжуулж эсвэл түүнээс гарч байгаа дулааны хэмжээтэй тэнцүү тул H утга нь фазын шилжилт (хайлах, буцалгах гэх мэт), химийн урвал болон тогтмол даралтын үед үүсэх бусад үйл явцын дулааны нөлөөллийг тодорхойлдог.
в) чөлөөт энерги - изохорик-изотермийн термодинамик потенциал эсвэл Гельмгольцын энергийн нэг нэр. Энэ нь эргэх боломжтой изотермийн процессын үед гадны ажил болж хувирдаг системийн дотоод энергийн хэсгийг илэрхийлдэг F \u003d F (V, T, N, x):
энд TS нь холбогдсон энерги юм.
Эрчим хүч изотермийн процесст ажлын хэлбэрээр дамжуулах боломжгүй дотоод энергийн хэсгийг илэрхийлнэ.
TS \u003d U - F. (2.66)
Иротермийн эргэлт буцалтгүй процессын явцад чөлөөт энергийн өөрчлөлт (бууралт) системийн хийж чадах хамгийн их ажлыг тодорхойлдог.
 ;
;
 .
(2.67)
.
(2.67)
d) Гиббсийн энерги - изобарик-изотермийн потенциал, чөлөөт энтальпи, бие даасан параметр p, T, N - G бүхий термодинамикийн системийн шинж чанар. д. "ашиг тустай" ажлын хамгийн их утгатай тэнцүү):
G \u003d G (p, T, N, x);  .
(2.68)
.
(2.68)
Гиббсийн энергийг чөлөөт энергитэй холбох:
 .
(2.69)
.
(2.69)
e) химийн чадавхи гэдэг нь нэг бөөмийн Гиббсийн энергитэй тэнцэх физик хэмжигдэхүүн юм.
Термодинамикийн гуравдахь хууль (Нернстийн теорем): абсолют тэг рүү ойртох температур дахь хоёр тэнцвэрийн төлөв байдлын хооронд үүсэх аливаа эргэж буцах изотермийн процессын системийн энтропийн өөрчлөлт (тэг). Термодинамикийн процессын дараалал нь абсолют тэгтэй тэнцүү температурт хүрч чадахгүй:
 .
(2.70)
.
(2.70)
Тэнцвэргүй үйл явцын термодинамик - тэнцвэргүй үйл явцыг макроскопоор тайлбарлах ерөнхий онол. Тэнцвэрт бус процессын термодинамикийн гол үүрэг бол тэнцвэрт байдлаас төдийлөн ялгаагүй төлөв байдалд эдгээр үйл явцыг тоон аргаар судлах явдал юм.
Олон нийтийг хамгаалах хууль:
 , (2.71)
, (2.71)
энд нь олон бүрэлдэхүүн хэсгийн системийн нягтрал юм;
v - координат ба цаг хугацаанаас хамааран орчны гидродинамик хурд (массын дамжуулалтын дундаж хурд);
∙ v - масс урсгал.
Аливаа бүрэлдэхүүн хэсгийн концентрацид массын хадгалалтын хууль  :
:
 ,
(2.72)
,
(2.72)
хаана c k - бүрэлдэхүүн хэсгийн концентраци;
k - бүрэлдэхүүн хэсгийн нягтрал;
нь орчны нягтрал;
J k \u003d k (v k - v) - тархалтын урсгал;
v k нь бүрэлдэхүүн хэсгийн гидродинамик хурд (массын дамжуулалтын дундаж хурд) юм.
Импульсийг хамгаалах хууль:элементийн эзэлхүүний импульсийн өөрчлөлт нь P medium, орчин ба гадаад хүчнүүдийн дотоод стрессийн градиентээс үүсэх хүчнээс шалтгаалж болно. F к.
Эрчим хүч хэмнэх хууль тэнцвэргүй үйл явцын термодинамикийн термодинамикийн нэгдүгээр хуулийг илэрхийлнэ.
Энтропийн тэнцлийн тэгшитгэл: тэнцвэргүй процессын термодинамикийн хувьд анхан шатны эзэлхүүний энтропи нь бүрэн тэнцвэрийн байдалтай адил дотоод энерги, тодорхой эзэлхүүн ба концентрацийн ижил функц юм гэж үздэг.
 ,
(2.73)
,
(2.73)
энд - энтропийн өсөлтийн хурд;
- бодисын нягтрал;
s нь анхан шатны эзлэхүүний энтропи (орон нутгийн энтропи);
J s нь энтропийн урсгалын нягтрал юм.
2.4. Бодит хий. Фазын тэнцвэр ба хувиргалт
Бодит хий - хий нь шинж чанарууд нь бөөмсийн харилцан үйлчлэл, тэдгээрийн эзэлхүүнээс хамаардаг бөгөөд энэ нь ялангуяа өндөр даралт, бага температурт илт мэдрэгддэг.
Бодит хийн төлөвийн тэгшитгэл (ван дер Ваалсын тэгшитгэл) дурын хийн массын хувьд:
 , (2.74)
, (2.74)
энд "а" нь молекул хоорондын хүчний нөлөөллийг (дотоод даралт дээр) Ван дер Ваалсын залруулга юм;
"c" - Ван дер Ваалсын молекулын дотоод эзэлхүүнийг засах;
μ нь хийн молекул жин;
m нь хийн масс.
Бодит хийн дотоод энерги молекулуудын шилжих ба эргэлтийн хөдөлгөөний кинетик энерги Е k ба тэдгээрийн харилцан үйлчлэлийн боломжит энерги Е p-ээс бүрдэнэ.
Нэг молийн бодит хийн молекулуудын харилцан үйлчлэлийн боломжит энерги сөрөг тэмдэгтэй, учир нь дотоод даралтыг үүсгэдэг молекулын хүч p "нь таталцлын хүч юм.
 .
(2.75)
.
(2.75)
Бодит хийн боломжит энергийн өөрчлөлт (мэнгэ) хий нь V 1-ээс V 2 хүртэлх хэмжээтэй болтлоо өргөжих үед дотоод даралтын гүйцэтгэсэн ажилтай тэнцүү байна.
 .
(2.76)
.
(2.76)
Бодит хийн молекулуудын кинетик энерги (мэнгэний хувьд) энергийг эрх чөлөөний зэрэгт тэнцүү хуваарилах теоремын дагуу (ойролцоогоор):
 .
(2.77)
.
(2.77)
Нэг молийн жинхэнэ хийн дотоод энерги:
 .
(2.78)
.
(2.78)
Адиабатик тэлэлт (энэ тохиолдолд хий хөрнө) эсвэл шахах (энэ тохиолдолд хий халаадаг) үед бодит хийн температурын өөрчлөлт:
 .
(2.79)
.
(2.79)
Жоул - Томсоны нөлөө - сүвэрхэг хуваалт дамжуулан өргөжүүлэх явцад бодит хийн температурын өөрчлөлт. Хэрэв тэлэлтийн явцад хий хөрдөг бол Жоул-Томсоны эффектийг эерэг, хэрэв халах юм бол сөрөг гэж нэрлэдэг.
Үе шат - физик шинж чанараараа ижил бодисын бусад боломжтой тэнцвэрт байдлаас ялгаатай бодисын тэнцвэрт байдал (термодинамикт).
Фазын өөрчлөлт - гадаад нөхцөл байдал өөрчлөгдсөн бодисын шинж чанарын чанарын өөрчлөлттэй холбоотой бодисыг нэг фазаас нөгөөд шилжүүлэх.
Фазын тэнцвэр - олон фазын систем дэх термодинамикийн тэнцвэрийн үеүүд нэгэн зэрэг оршин тогтнох.
Гиббсийн үе шатны дүрэм: n бүрэлдэхүүн хэсгээс бүрдэх бодисын хувьд (n + 2) тэнцвэрийн үе шат нэгэн зэрэг оршин тогтнох боломжгүй юм.
Фазын тэнцвэрийг зөрчихгүйгээр сольж болох системийн физик параметрүүдийн тоо:
L \u003d n + 2 - , (2.80)
энд нь тэнцвэрт байдал дахь фазын тоо юм.
Клапейрон-Клаузиусын тэгшитгэл температурын өөрчлөлтийг тодорхойлдог фазын шилжилт даралтын хязгааргүй бага өөрчлөлттэй:
 ;
;
 ;
; ,
(2.81)
,
(2.81)
энд Q нь фазын шилжилтийн дулаан;
T нь шилжилтийн температур;
dp / dT - температурын талаархи даралтын дериватив;
dT / dp - даралтын талаархи температурын дериватив;
(V 2 - V 1) - бодисын эхний фазаас хоёр дахь шат руу шилжих явцад түүний эзлэхүүний өөрчлөлт.
Металл төлөв байдал - физик макроскопийн системийн тогтворгүй тэнцвэрийн байдал (фаз). Систем нь илүү тогтвортой (өгөгдсөн нөхцөлд) төлөвт (фаз) шилжихгүйгээр энэ төлөвт удаан хугацаанд байж болно.
Фазын тэнцвэрийн шугам (гадаргуу) - фазын тэнцвэрийн нөхцөлд зарим термодинамикийн хувьсагчдын бусдаас хамаарлыг харуулсан график зураглал.
Төлөв диаграмм - фазын тэнцвэрийн шугам (гадаргуу) -ын багц.
Гурвалсан цэг -фазын тэнцвэрийн нэг шугамыг (гадаргуу) нөгөө шугамтай огтлолцох цэг.
Чухал цэг гэдэг нь тухайн бодисын чухал төлөв байдалд харгалзах төлөвийн диаграммын цэг юм. Чухал цэг дэх бодисын төлөв байдал нь температур k k, даралт p k ба эзэлхүүн V k-ийн чухал утгуудаар тодорхойлогддог.
Хоёр фазын тэнцвэрт байдлын хувьд чухал цэг - фазын тэнцвэрийн шугамын (гадаргуугийн) төгсгөлийн цэг.
Шилжилтийн цэг - фазын шилжилт явагдах температур, даралт эсвэл бусад утгын утга.
Эхний дарааллын үе шат хэрэгжилтийн явцад тодорхой хэмжээний дулааныг шингээж эсвэл ялгаруулдаг бөгөөд үүнийг фазын шилжилтийн дулаан гэж нэрлэдэг. Бодисын ийм термодинамик хэмжигдэхүүний утга нягтрал, бүрэлдэхүүн хэсгүүдийн концентраци огцом өөрчлөгддөг.
Хоёр дахь шатны үе шат - шилжилтийн цэгийн нэг тал дээр тэгтэй тэнцэх тодорхой физик хэмжигдэхүүн нөгөө чиглэлд шилжилтийн цэгээс зайтай болох тусам аажмаар нэмэгдэж, ийм бодисын нягтрал тасралтгүй өөрчлөгдөж, дулааныг шингээж, ялгаруулдаггүй ийм шилжилт.
2.5. Кинетик үзэгдэл (шилжүүлэх үзэгдэл)
Кинетик үзэгдэл (шилжүүлэх үзэгдэл) - тэнцвэргүй байдлаас тэнцвэрт байдалд шилжих аливаа системийн шилжилтийн үр дүнд аливаа биет хэмжигдэхүүнийг шилжүүлэхтэй холбоотой эргэлт буцалтгүй үйл явц.
Молекулын физикийн кинетик үзэгдэл - зуурамтгай чанар, дулаан дамжуулалт, тархалт.
Зуурамтгай чанар (дотоод үрэлт) - шилжүүлэх үзэгдэл, үүний үр дүнд молекулуудын импульс (импульс) нэг хий эсвэл шингэний давхаргаас нөгөө рүү шилжих явдал юм.
Шингэн эсвэл хийн доторх дотоод үрэлтийн хүчийг Ньютоны томъёогоор тодорхойлно.
 ,
(2.82)
,
(2.82)
энд нь зуурамтгай байдлын коэффициент;
S - шингэн эсвэл хийн давхаргын холбоо барих талбай;
dv / dz - урсгалын чиглэлд перпендикуляр чиглэлд шингэн эсвэл хийн урсгалын хурдны градиент;
Динамик зуурамтгай байдлын коэффициент - нэг талбайн хурдны градиентэд нэгж талбайн шингэн буюу хийн хоёр давхаргын хоорондох дотоод үрэлтийн хүчтэй тэнцүү биет хэмжээ:
 эсвэл
эсвэл  ,
(2.83)
,
(2.83)
n 0 бол нэгж эзэлхүүн дэх молекулын тоо;
u - молекулуудын дулааны хөдөлгөөний дундаж хурд;
m нь молекулын масс;
нь молекулуудын чөлөөт дундаж зам юм;
\u003d n 0 ∙ m - шингэн эсвэл хийн нягт.
Кинематик зуурамтгай байдлын коэффициент - динамик зуурамтгай чанар ба бодисын нягтралын харьцаа:
ν \u003d η / ρ. (2.84)
Тархалт - гадны бодисын дулааны хөдөлгөөнөөс шалтгаалан молекулууд (атомууд) харилцан нэвтрэх үйл явц. Тархалт нь бодисын массын шилжүүлгээр үргэлж дагалддаг. Энэ нь хий, шингэн, хатуу бодисын хувьд түгээмэл байдаг.
Өөрийгөө сарниулах - дулааны хөдөлгөөнөөс шалтгаалан өөрийн молекулууд (атомууд) харилцан нэвтрэх үйл явц.
Тархалтын тухай хууль (Фикийн анхны хууль) :
 ,
(2.85)
,
(2.85)
энд D нь тархалтын коэффициент;
dс / dz - концентрацийн z чиглэлд өөрчлөгдөх хурд (градиент);
"хасах" - массыг энэ бүрэлдэхүүн хэсгийн концентраци буурах чиглэлд шилжүүлж байгааг харуулж байна.
Тархалтын коэффициент - нэг нэгжийн концентрацийн градиенттай тэнцүү хугацаанд нэгж талбайгаар авч явсан бодисын масстай тоон хувьд тэнцүү биет хэмжээ:
 ,
(2.86)
,
(2.86)
хаана
<> молекулуудын дундаж чөлөөт зам юм.
Дулаан дамжуулалтын - температурын зөрүүгээс үүсэх холбоо барих биетүүд эсвэл ижил биеийн хоёр гадаргуугийн хоорондох энерги шилжүүлэх үйл явц.
Дулаан дамжилтын тухай хууль (Фурьегийн хууль) - dt хугацааны туршид dS сайтаар дамжуулсан dQ дулааны хэмжээ:
 ,
(2.87)
,
(2.87)
энд æ нь дулаан дамжилтын илтгэлцүүр юм;
dT / dz - температурын z чиглэлд өөрчлөгдөх хурд (градиент).
Дулаан дамжилтын илтгэлцүүр нь температурын градиенттэй тэнцүү хугацаанд нэгж нэгжид хичнээн дулаан дамжуулж байгааг харуулдаг физик хэмжигдэхүүн юм.
 ,
(2.88)
,
(2.88)
энд c v нь тогтмол эзэлхүүн дэх тодорхой дулаан юм.
Дулааны урсгал температурын градиент dT / dz бүхий dS талбайгаар нэгж хугацаанд хичнээн их дулаан дамжуулж байгааг харуулсан физик хэмжигдэхүүн юм.

 .
(2.89)
.
(2.89)
Дулаан дамжилтын илтгэлцүүр, тархалт ба зуурамтгай чанар хоорондын хамаарал:
 ; \u003d D;
; \u003d D;  .
(2.90)
.
(2.90)
Онлайн сургалтыг ашиглан гэрчилгээ авах боломжтой.
Энэ хичээл нь термодинамик ба молекулын физикийн гол ойлголт, аргуудыг Москвагийн Физик Технологийн Институтийн оюутнуудад заадаг ерөнхий физикийн хичээлийн нэг хэсэг болгон судалдаг. Юуны өмнө термодинамикийн үндсэн хэмжигдэхүүн, үзэл баримтлал, постулатыг танилцуулсан болно. Термодинамикийн үндсэн харилцааг авч үзсэн болно. Тусдаа лекцүүд нь фазын шилжилтийн онол, Ван дер Ваалсын хийн загвар, гадаргын үзэгдлүүдэд зориулагдсан болно. Статистикийн физикийн үндсэн ойлголтуудыг өгсөн болно: системийн бичил ба макро төлөв байдал, хуваах функц, тархалтын функцууд гэх мэт. Максвелл, Больцманн, Гибсс тархалтын талаар ярилцав. Хийн дулааны багтаамжийн онолын элементүүдийг танилцуулсан болно. Термодинамикийн үндсэн хэмжигдэхүүний хэлбэлзлийн илэрхийлэлийг гаргалаа. Хийн молекулын процессын тодорхойлолтыг өгсөн: дамжуулах, тархах, дулаан дамжуулах процессууд.
Курсын тухай
Онлайн курс нь физикийн үндсэн асуудлын хэлэлцүүлэг, асуудлын дүн шинжилгээ, физик туршилтыг харуулах, ерөнхий физикийн талаар гүнзгий ойлголт авах боломжгүй юм. Онлайн сургалтыг амжилттай эзэмшихийн тулд сонсогч нь физикийн ерөнхий хичээлийг мэддэг байх ёстой: "Механик" ба математик анализын үндсийг эзэмшиж, шугаман алгебр, магадлалын онолын үндсийг мэддэг байх ёстой.
Формат
Онлайн курс нь онолын материал, үзэгдлийг зөв ойлгоход шаардлагатай термодинамикийн гол туршилтуудын жагсаалт, ердийн асуудлуудын шийдлийг шинжлэх, бие даан шийдвэрлэх дасгал, даалгаврыг агуулдаг.
Долоо, арван гурав, арван найм дахь долоо хоногт баталгаажуулах хяналтын даалгавруудыг агуулдаг.
Хичээлийн хөтөлбөр
1 дэх долоо хоног
Молекулын физик ба термодинамикийн үндсэн ойлголтууд: судалгааны сэдэв, түүний онцлог шинж чанарууд. Молекулын физикийн асуудлууд. Төлөвийн тэгшитгэл. Молекулуудын кинетик энергийн функц болох хамгийн тохиромжтой хийн даралт. Идеал хийн температур ба түүний молекулуудын кинетик энерги хоорондын хамаарал. Хамгийн тохиромжтой хийнүүдийн хууль. Төлөв байдлын хийн тэгшитгэл. Хагас статик, эргэлт буцалтгүй, эргэлт буцалтгүй термодинамик процессууд. Термодинамикийн тэг зарчим. Ажил, дулаан, дотоод эрч хүч. Термодинамикийн анхны хууль. Дулааны багтаамж. Тогтмол эзэлхүүн ба тогтмол даралттай үед хамгийн тохиромжтой хийн дулааны багтаамж, Майерын тэгшитгэл. Адиабатик ба политроп үйл явц. Хамгийн тохиромжтой хийн политроп тэгшитгэл. Адиабатик ба политроп үйл явц. Хамгийн тохиромжтой хийн дотоод энергийн хэмжээнээс хамааралгүй байх.
2 дахь долоо хоног
Термодинамикийн хоёрдахь хууль. Хоёр дахь эхлэлийн томъёолол. Дулааны хөдөлгүүр. Дулааны хөдөлгүүрийн үр ашгийг тодорхойлох. Карногийн мөчлөг. Карногийн теорем. Клаузиусын тэгш бус байдал. Карногийн мөчлөгийн бусад термодинамик мөчлөгтэй харьцуулахад хамгийн их үр ашиг. Хөргөлтийн машин. Чиллерийн үр ашиг. Дулааны насос. Карногийн мөчлөгийг ашиглан дулааны насосны үр ашиг. Дулааны насос ба хөргөгчийн үр ашгийн хүчин зүйлсийн хамаарал.
3 дахь долоо хоног
Энтропийн термодинамикийн тодорхойлолт. Өсөн нэмэгдэж буй энтропийн тухай хууль. Хамгийн тохиромжтой хийн энтропи. Буцаах ба эргэлт буцалтгүй процесст энтроп. Идеал хийн вакуум руу адиабатик тэлэлт. Термодинамикийн эхний ба хоёр дахь зарчмуудын хосолсон тэгшитгэл. Термодинамикийн гуравдугаар хууль. Температур үнэмлэхүй тэг болоход энтропи ба дулааны багтаамжийн өөрчлөлт.
4 дэх долоо хоног
Термодинамикийн функцууд. Термодинамик функцын шинж чанарууд. Ажлын дээд ба доод хэмжээ. Термодинамикийн функцүүдийн өөрчлөлт. Максвеллийн харилцаа. Дотоод энергийн эзэлхүүнээс хамаарал. Дулааны багтаамжийн эзэлхүүнээс хамаарал. CP ба CV-ийн харьцаа. Хатуу биетүүдийн термофизикийн шинж чанарууд. Хатуу биетийн хэв гажилтын термодинамик. Уян хатан савааны адиабат таталтын үед температурын өөрчлөлт. Сүлжээ дэх чичирхийллийн анармоник байдлын үр дүнд дулааны өргөтгөл. Баарны шугаман өргөтгөлийн коэффициент.
5 дахь долоо хоног
Термодинамикийн тэнцвэрт байдлын нөхцөл. Фазын өөрчлөлт. Эхний болон хоёр дахь төрлийн шилжилт. Химийн чадавхи. Фазын тэнцвэрийн байдал. Фазын тэнцвэрийн муруй. Клапейрон - Клаузиусын тэгшитгэл. "Шингэн уур" гэсэн хоёр фазын системийн төлөв байдлын диаграмм. Фазын шилжилтийн дулааны температурын хамаарал. Чухал цэг. Гурвалсан цэг. "Мөс-ус-уур" төлөв байдлын диаграмм. Гадаргуугийн үзэгдэл. Гадаргуугийн термодинамик. Гадаргуугийн чөлөөт энерги. Булангийн ирмэг. Нойтон, нойтон биш. Лапласын томъёо. Шингэн гадаргуугийн муруйлтаас уурын даралтын хамаарал. Буцалж байна. Шинэ үе шат бүрдүүлэхэд бөөмүүдийн гүйцэтгэх үүрэг.
6 дахь долоо хоног
Ван дер Ваальс хий нь жинхэнэ хийн загвар юм. Ван дер Ваалсын хийн изотермууд. Metastable төлөв байдал. Хэт халсан шингэн ба хэт хөргөсөн уур. Максвеллийн дүрэм ба хөшүүргийн дүрэм. Ван-дер-Ваалсын хийн чухал нөхцөл ба бууруулсан тэгшитгэл. Ван дер Ваалсын хийн дотоод энерги. Ван дер Ваалсын хийн адиабат тэгшитгэл. Ван дер Ваалсын хийн энтропи. Хийн дууны хурд. Нүхнээс гарах хийн урсгалын хурд. Жоул - Томсоны нөлөө. Адиабатик өргөтгөл, тохируулга. Бага температурт орох.
7 дахь долоо хоног
Баталгаажуулалт
8 дахь долоо хоног
Динамик ба статистик хэв маяг. Макроскоп ба микроскоп нөхцөл. Үе шат. Магадлалын онолын элементүүд. Хэвийн байдал. Дундаж ба хэлбэлзэл. Хоёртын тархалтын тухай хууль. Пуассоны тархалт. Гауссын тархалт.
9 дэх долоо хоног
Максвелл тархалт. Хурдны бүрэлдэхүүн хэсгүүд ба үнэмлэхүй хурдны утгуудаар бөөмийн тархалт. Хамгийн их магадлалтай, дундаж ба язгуурын дундаж квадрат хурд. Максвелл эрчим хүчний хуваарилалт. Нэгж хугацаанд нэгж нэгжтэй мөргөлдөх молекулуудын нөлөөллийн дундаж тоо. Молекулуудын дундаж энерги нь савны жижиг нүхээр вакуум руу цацагдана.
10 дахь долоо хоног
Больцманы тархалт нэгэн төрлийн хүчний талбарт. Барометрийн томъёо. Микро ба макро төлөв. Макростатын статистик жин. Энтропийн статистик тодорхойлолт. Хийн холимог дахь энтропи. Гиббсийн парадокс. Гиббсийн тархалтын тухай ойлголт. Статистикийн нийлбэр ба түүний дотоод энергийг олоход ашиглах. Статистик температур.
11 дэх долоо хоног
Хэлбэлзэл. Бөөмийн энергийн энерги ба дисперсийн дундаж утга (язгуур-квадрат хэлбэлзэл). Термодинамик хэмжигдэхүүний хэлбэлзэл. Тогтмол эзэлхүүн дэх температурын хэлбэлзэл. Изотерм ба адиабат процессын эзлэхүүний хэлбэлзэл. Нэмэлт физик хэмжигдэхүүний хэлбэлзэл. Системийг бүрдүүлж буй ширхэгийн тооноос хэлбэлзлийн хамаарал.
12 дахь долоо хоног
Дулааны багтаамж. Дулааны багтаамжийн сонгодог онол. Дулааны хөдөлгөөний энергийг эрх чөлөөний зэрэгт жигд хуваарилах хууль. Кристалуудын дулааны багтаамж (Дулонг - Petit law). Дулааны багтаамжийн квант онолын элементүүд. Онцлог температур. Дулааны багтаамжийн температураас хамаарах байдал.
13 дахь долоо хоног
Мөргөлдөөн. Үр дүнтэй хийн кинетик хэсэг. Чөлөөт замын урт. Молекулуудын чөлөөт замын хуваарилалт. Молекулуудын хоорондоо мөргөлдөх тоо. Тээврийн үзэгдэл: зуурамтгай чанар, дулаан дамжуулалт ба тархалт. Фик, Фурье нарын хуулиуд. Хийн доторх наалдамхай чанар, дулаан дамжуулалт ба тархалтын коэффициентууд.
14 дэх долоо хоног
Броуны хөдөлгөөн. Хөдөлгөөнт байдал. Эйнштейн - Смолучовскийн хууль. Бөөмсийн хөдөлгөөн ба тархалтын коэффициент хоорондын хамаарал. Ховордсон хий дэх тээврийн үзэгдэл. Кнудсены нөлөө. Үр нөлөө. Шууд хоолойгоор дамжин ховордсон хий урсдаг.
15 дахь долоо хоног
Баталгаажуулалт
Сургалтын үр дүн
"Термодинамик" хичээлийг судалсны үр дүнд оюутан дараахь зүйлийг хийх ёстой.
- Мэдэх:
- молекул физик, термодинамикт ашигладаг үндсэн ойлголтууд;
- молекулын физикт ашигладаг физик хэмжигдэхүүний утга, термодинамик;
- хамгийн тохиромжтой хий ба ван дер Ваалсын хийн төлөв байдлын тэгшитгэл;
- больцман, Максвелл нарын хуваарилалт, энергийн эрх чөлөөний зэргээр жигд тархах хууль;
- тэг, термодинамикийн эхний, хоёр, гурав дахь зарчим, Клаузиусын тэгш бус байдал, энтропийн өсөлтийн хууль;
- тогтвортой термодинамикийн тэнцвэрт байдал;
- клапейрон-Клаузиусын тэгшитгэл;
- лапласийн томъёо;
- дамжуулах процессыг тодорхойлсон тэгшитгэл (тархалт, зуурамтгай чанар, дулаан дамжуулалт);
- Боломжтой байх:
- асуудлыг шийдвэрлэхэд хийн молекул-кинетикийн онолын үндсэн заалтуудыг ашиглах;
- дулааны процесс ба дамжуулах процессын тэнцвэрт байдлыг тодорхойлохдоо молекулын физик ба термодинамикийн хуулийг ашиглах;
- Өөрийн:
- бодисын төлөв байдлын параметрийг тооцоолох аргууд;
- ажлын тооцоо хийх арга, дулааны хэмжээ, дотоод энерги;
Чадварыг бий болгосон
- шинжлэх ухааны асуудал, физик процесст дүн шинжилгээ хийх, байгалийн шинжлэх ухааны салбарт олж авсан суурь мэдлэгээ практикт ашиглах чадвар (OK-1)
- шинэ асуудал, нэр томъёо, арга зүй, шинжлэх ухааны мэдлэгийг эзэмших чадвар, бие даан суралцах чадвар эзэмшүүлэх (OK-2)
- физик, математикийн салбарын чиглэлээр олж авсан мэдлэгээ мэргэжлийн үйл ажиллагаандаа ашиглах чадвар (PC-1)
- мэргэжлийн үйл ажиллагааны явцад тавьсан даалгаврын мөн чанарыг ойлгох, тэдгээрийг тайлбарлах, шийдвэрлэхэд тохирох физик-математикийн аппаратыг ашиглах чадвар (PC-3)
- сургалтын профайл (PC-4) -ын дагуу физик, математикийн салбар дахь мэдлэгээ ашиглан салбарыг цаашид хөгжүүлэхэд ашиглах чадвар.
- чанарын болон тоон загварыг бий болгоход математик, физик, компьютерийн онол, арга зүйг ашиглах чадвар (PC-8)
Сэдэв 8. Феноменологийн термодинамик
Термодинамик молекулуудын дулааны хөдөлгөөнөөс шалтгаалан энерги хувиргах тоон хуулиудыг судалдаг. Термодинамикийн үндэс нь хүний \u200b\u200bүйл ажиллагааны олон зууны туршлагыг нэгтгэх хоёр үндсэн хуулиар бүрддэг бөгөөд үүнийг термодинамикийн зарчим гэж нэрлэдэг. Эхний эхлэл нь энерги хувиргах үйл явцын тоон болон чанарын талыг тодорхойлдог; хоёр дахь эхлэл нь эдгээр үйл явцын чиглэлийг дүгнэх боломжийг бидэнд олгодог.
Термодинамикийн систем - дулааныг бусад энерги рүү шилжүүлэх үйл явцаар тодорхойлогддог макроскоп байгууллага (эсвэл бүлэг биетүүд). Термодинамикийн системийн жишээ бол поршений доор цилиндрт баригдсан хий юм.
Термодинамикийн системийн төлөв байдлыг гурван параметрээр өвөрмөцөөр тодорхойлдог. даралт, температур ба эзэлхүүнгэж нэрлэдэг төлөвийн параметрүүд.
Тэнцвэрийн байдалтермодинамикийн системийн (эсвэл термодинамикийн тэнцвэрийн төлөв байдал) гэдэг нь төлөвийн параметрүүд өөрчлөгдөөгүй гаднах нөхцөлд дур мэдэн удаан хугацаанд өөрчлөгдөхгүй байхыг хэлнэ. Төлөв байдлын график дээрх тэнцвэрт байдлыг цэгээр дүрслэв.
Гэсэн хэдий ч системийн төлөвийг нэг параметрийн утгаар тодорхойлж болохгүй, жишээлбэл: жигд бус халсан биеийг нэг температурын утгаар тодорхойлох боломжгүй юм. Параметрийн тодорхой нэг утгаар тодорхойлогдох боломжгүй системийн төлөвүүд нь тэнцвэргүй байдал юм. Тэнцвэргүй байдал - өөр өөр цэгүүдийн термодинамикийн параметрүүд өөр өөр байх төлөв.
Хөдөлгөөнгүй байдал термодинамикийн систем - системийн төлөвийн параметрүүд цаг хугацааны хувьд болон системийн бүх хэсэгт тогтмол хэвээр байх төлөв.
Термодинамик процесс - системийн төлөв байдлыг өөрчлөх. Тэнцвэрийн процессын график дүрслэлийг төлөв байдлын диаграмм гэж нэрлэдэг.
Тэнцвэрийн үйл явц - тэнцвэрийн төлөв байдлын тасралтгүй дараалалаас бүрдэх процесс. Зөвхөн хязгааргүй удаан эргэлт буцалтгүй үйл явц л тэнцвэрт байдалд байж болно. Эдгээр шаардлагыг хангаагүй процессууд - тэнцвэргүй байдал... Зөвхөн тэнцвэрийн үйл явцыг графикаар дүрслэх боломжтой - тэнцвэрийн төлөв байдлын дараалалаас бүрдэх процессууд.
Бүх бодит процессууд нь тэнцвэргүй байдал юм (тэдгээр нь хязгаарлагдмал хурдтай явагддаг) боловч зарим тохиолдолд бодит үйл явцын тэнцвэргүй байдлыг үл тоомсорлож болно (процесс удаан явагдах тусам тэнцвэрт ойртох болно). Үүний дараа авч үзэж буй үйл явцыг тэнцвэрт байдалд тооцно.
Дотоод энерги Термодинамик системийг бүхэлд нь түүний шилжүүлэх хөдөлгөөний энерги болон системийн гадаад потенциалын энергийг хасч эзэмшдэг бүх төрлийн энергийн нийлбэр гэж нэрлэдэг. Дотоод энергийн дор У термодинамикийн хувьд бид системийг бүрдүүлж буй бөөмсийн дулааны хөдөлгөөний энерги ба тэдгээрийн байрлалын боломжит энергийг ойлгох болно.
Учир нь хамгийн тохиромжтой хий молекулуудын харилцан үйлчлэлийн боломжит энергийг тэг гэж үзнэ. Тиймээс нэг молийн хамгийн тохиромжтой хийн дотоод энерги дараахь хэмжээтэй тэнцүү байна.
Томъёо (1) -ээс харахад хамгийн тохиромжтой хийн дотоод энерги нь үнэмлэхүй температуртай пропорциональ байна.
Дотоод энерги нь дараах шинж чанартай байдаг.
- дулааны тэнцвэрт байдалд системийн бөөмсүүд хөдөлж, тэдгээрийн нийт энерги нь үргэлж дотоод энергитэй тэнцүү байх болно;
- дотоод энерги нь нэмэлт хэмжигдэхүүн юм. бие махбодийн системийн дотоод энерги нь системийг бүрдүүлж буй биеийн дотоод энергийн нийлбэртэй тэнцүү байна;
- системийн дотоод энерги нь түүний төлөв байдлын хоёрдмол утгагүй функц юм. системийн төлөв бүр нь зөвхөн нэг энергийн үнэ цэнэтэй байдаг; энэ нь нэг төлөвөөс нөгөөд шилжих явцад дотоод энерги өөрчлөгдөх нь шилжилтийн замаас хамаарахгүй гэсэн үг юм. Өөрчлөлт нь шилжилтийн замаас хамаардаггүй хэмжигдэхүүнийг термодинамик гэж нэрлэдэг төрийн функц:
DU \u003d U 2 -U 1 нь процессын төрлөөс хамаардаггүй.
Эсвэл  , энд U 2 ба U 1 - 1 ба 2 муж дахь дотоод энергийн утга. Энд dU - нийт дифференциал.
, энд U 2 ба U 1 - 1 ба 2 муж дахь дотоод энергийн утга. Энд dU - нийт дифференциал.
Дараахь тохиолдолд системийн дотоод энерги өөрчлөгдөж болно.
- систем гаднаас нь авдаг эсвэл хүрээлэн буй бие махбодид ямар нэгэн байдлаар ямар нэгэн энерги өгдөг;
- систем нь үүн дээр ажилладаг гадны хүчний эсрэг ажилладаг.
Термодинамикийн анхны хууль Биеийн төлөв байдлыг тодорхойлох чухал үзүүлэлтүүдийн нэг нь температур байдаг макроскопийн үзэгдлүүдийн хувьд энерги хэмнэх хуулийг илэрхийлдэг.
Төлөвийг өөрчлөх явцад системд өгөх дулааныг дотоод энергийг нь өөрчлөх, гадны хүчний эсрэг ажил гүйцэтгэхэд зарцуулдаг.
Q \u003d DU + БА(1)
Ихэнхдээ авч үзэж буй процессыг хэд хэдэн үндсэн процесст хуваах шаардлагатай байдаг бөгөөд тус бүр нь системийн параметрүүдийн маш бага өөрчлөлттэй тохирч байдаг. Анхан шатны процессын тэгшитгэл (1) -ийг дифференциал хэлбэрээр бичье. dQ \u003d dU + dA, (2)
хаана dU - дотоод энергийн бага зэргийн өөрчлөлт; г.Q нь дулааны үндсэн хэмжээ; г.А - анхан шатны ажил.
(1) ба (2) тэгшитгэлээс харахад процесс нь дугуй хэлбэртэй байвал, өөрөөр хэлбэл. Үүний үр дүнд систем анхны байдалдаа эргэж орно Д.У. \u003d 0 ба иймээс Q \u003d A. Дугуй процесст системд хүлээн авсан бүх дулааныг гадны ажилд зарцуулдаг.
 Хэрвээ U 1 \u003d U 2 болон Q \u003d A, дараа нь A \u003d O Энэ нь тийм гэсэн үг юм үйл явц боломжгүй бөгөөд үүний цорын ганц үр дүн нь бусад бие махбодид өөрчлөлт ороогүй ажил хийх явдал юм. тэдгээр. боломжгүй мөнхийн гар утас(мөнхийн хөдөлгөөнт машин) анхны төрлийн.
Хэрвээ U 1 \u003d U 2 болон Q \u003d A, дараа нь A \u003d O Энэ нь тийм гэсэн үг юм үйл явц боломжгүй бөгөөд үүний цорын ганц үр дүн нь бусад бие махбодид өөрчлөлт ороогүй ажил хийх явдал юм. тэдгээр. боломжгүй мөнхийн гар утас(мөнхийн хөдөлгөөнт машин) анхны төрлийн.
 Хийн өргөтгөлийн үйл явцыг авч үзье. Цилиндр хэлбэртэй саванд хөдлөх поршений хаалттай хий орно (Зураг 39.1). Хий нь тэлж байна гэж бодъё. Тэрээр поршенийг хөдөлгөж, түүн дээр ажиллана. Бага нүүлгэн шилжүүлэлттэй үед dx хий нь ажлыг хийх болно dA \u003d F dx, Хаана F- хийн нь поршений үйлчлэх хүч, r - хийн даралт ондаяллын эхлэл dx. Тиймээс, dQ \u003d pSdx \u003d pdV, Хаана dV - хийн эзэлхүүний бага өөрчлөлт. Хязгаарлагдмал эзлэхүүний өөрчлөлтөөр хийсэн ажлыг нэгтгэх замаар тооцоолох ёстой. Бүрэн өргөтгөлийн ажил:
Хийн өргөтгөлийн үйл явцыг авч үзье. Цилиндр хэлбэртэй саванд хөдлөх поршений хаалттай хий орно (Зураг 39.1). Хий нь тэлж байна гэж бодъё. Тэрээр поршенийг хөдөлгөж, түүн дээр ажиллана. Бага нүүлгэн шилжүүлэлттэй үед dx хий нь ажлыг хийх болно dA \u003d F dx, Хаана F- хийн нь поршений үйлчлэх хүч, r - хийн даралт ондаяллын эхлэл dx. Тиймээс, dQ \u003d pSdx \u003d pdV, Хаана dV - хийн эзэлхүүний бага өөрчлөлт. Хязгаарлагдмал эзлэхүүний өөрчлөлтөөр хийсэн ажлыг нэгтгэх замаар тооцоолох ёстой. Бүрэн өргөтгөлийн ажил:  .
.
График дээр (p, V) ажил нь хоёр ординат ба p (V) функцээр хязгаарлагдсан зурагны талбайтай тэнцүү байна (Зураг 39.2).
Систем нь нэг төлөвөөс нөгөө төлөв рүү шилжиж, өргөтгөлийн ажлыг гүйцэтгэдэг гэж бодъё, гэхдээ I ба II гэсэн хоёр өөр аргаар: p 1 (V) ба p 2 (V): 
A I нь тоон утгаараа I муруйгаар хязгаарлагдсан зургийн талбайтай тэнцүү, A II нь II муруйгаар хязгаарлагдсан зургийн талбай юм: A I No A II.
(4) илэрхийлэлийг харгалзан термодинамикийн нэгдүгээр хуулийн тэгшитгэлийг дараах байдлаар бичиж болно.
dQ \u003d dU + pdV.
Биеийн системийн дулааны багтаамж (бие) дулааны хэмжээтэй харьцуулсан физик хэмжигдэхүүн гэж нэрлэдэг dQ, бие махбодийн системийг халаахад зарцуулах ёстой, температурын өөрчлөлтөд dT,энэ халаалтыг тодорхойлох:  ... [C] \u003d J / K
... [C] \u003d J / K
Тодорхой дулаанбодисууд -аас нэг төрлийн биеийн дулааны багтаамжийн харьцаатай тэнцүү скаляр хэмжигдэхүүн гэж нэрлэдэг ДАХЬ түүний масс руу: 
[в] \u003d J / (кг.K)
Молийн дулааны багтаамж системийн дулааны багтаамжийн харьцаатай тоон хувьд тэнцүү биет хэмжигдэхүүн гэж нэрлэдэг ДАХЬ түүнд агуулагдах n бодисын хэмжээгээр:  ... \u003d J / (моль K)
... \u003d J / (моль K)
Тогтмол эзэлхүүн ба тогтмол даралтын үед молийн дулааны багтаамжийг ялгах:
Тогтмол даралт ба тогтмол эзэлхүүн дэх дулааны багтаамжийг холбосон тэгшитгэл нь дараахь хэлбэртэй байна (Майерын тэгшитгэл): C p - C V \u003d R.
Эрх чөлөөний зэрэг болон Мэйерийн тэгшитгэлийн энергийн хуваарилалтыг харгалзан бид C p ба C V дулааны багтаамжийн чөлөөт зэрэг дээр тархалтыг олж авна.  болон
болон  .
.
Термодинамик процессыг авч үзэхдээ дараахь харьцааг ашиглах нь тохиромжтой байдаг.  .
.
G-ийн утгыг молекулын чөлөөт байдлын тоо, шинж чанараар тодорхойлно.
Хийн тэнцвэрт изопроцессын хувьд термодинамикийн нэгдүгээр хуулийн тэгшитгэл дараахь хэлбэртэй байна.  .
.
Изохорик процесст термодинамикийн эхний хууль (V \u003d const):
Энд DТ \u003d Т 2 –Т 1 нь эцсийн ба анхны төлөвүүдийн температурын зөрүү юм. Энэ тохиолдолд ажил хийгдэхгүй: 
 Изобарийн процесст термодинамикийн эхний хууль (p \u003d const): .
Изобарийн процесст термодинамикийн эхний хууль (p \u003d const): .
Изобарик процессын графикийг Зураг 41.1-д үзүүлэв. Изобарик тэлэлтийн ажил нь зураг дээрх сүүдэрлэсэн дүрсний талбайн хэмжээтэй тэнцүү бөгөөд утгатай болно
 .
.
Энд бид Майерын тэгшитгэлийг гаргаж, бүх нийтийн хийн тогтмол байдлын физик утгыг томъёолох боломжтой болно.
 .
.
Изобарик процессын хувьд (Менделеев-Клапейрон тэгшитгэлийг харгалзан үзэх)  .
.
Тиймээс  ,
,
 (Майерын тэгшитгэл)
(Майерын тэгшитгэл)
Бүх нийтийн хийн тогтмол1 моль бодисыг тогтмол даралтаар 1 К-ээр халаахын тулд хийх ёстой ажилтай тэнцүү байна.
 Изотермийн процесст термодинамикийн эхний хууль (T \u003d const):
Изотермийн процесст термодинамикийн эхний хууль (T \u003d const):  - изотермийн процессын явцад системд өгөх дулаан нь гадны хүчний эсрэг ажиллахад хүргэдэг.
- изотермийн процессын явцад системд өгөх дулаан нь гадны хүчний эсрэг ажиллахад хүргэдэг.

Тиймээс изотермийн процессоор ажиллана уу.
 .
.
Дотоод энергийн өөрчлөлт dU \u003d 0, системийн дулааны багтаамж хязгааргүйтэй тэнцүү байна.
Хэрэв хий нь изотермээр өргөжиж байвал (V 2\u003e V 1) дулааныг түүнд нийлүүлж, эерэг ажил гүйцэтгэдэг бөгөөд энэ нь зураг дээрх сүүдэрлэсэн талбайгаар хэмжигддэг. Хэрэв хий нь изотермээр шахагдсан бол (V 2 Адиабатикнь гадаад орчинтой дулаан солилцохгүйгээр тохиолддог процесс юм. dQ \u003d 0, Q \u003d 0 Процесс нь адиабат байхын тулд системийг дулаан тусгаарлагч хуваалтаар хүрээлэн буй биеэс тусгаарлах шаардлагатай эсвэл процесс нь маш хурдан бөгөөд маш хурдан явагдах ёстой бөгөөд дулааны солилцоог бий болгож чадахгүй. Тэгэхээр адиабат процессын хувьд төлөвийн тэгшитгэл нь: Менделеев-Клапейрон тэгшитгэлээс: T \u003d pV / R Менделеев-Клапейрон тэгшитгэлээс: V \u003d RT / p. (1), (2) ба (3) тэгшитгэлүүд нь Пуассоны тэгшитгэл гэж нэрлэгддэг адиабат процессын тэгшитгэл юм. Энэ баримтыг молекул-кинетикийн үүднээс тайлбарлах нь: хийн даралт нь савны хананд молекулын нөлөөллөөс үүдэлтэй юм. Изотермийн процесст нэгж талбайд ногдох нэгж хугацаанд ногдох молекулын нөлөөллийн тоо өөрчлөгдөж, нөлөөллийн дундаж хүч өөрчлөгддөггүй. Адиабатик процесст нэгж хугацаанд үзүүлэх нөлөөллийн дундаж тоо ба нөлөөллийн дундаж хүч хоёулаа өөрчлөгддөг. Термодинамикийн нэгдүгээр хууль нь байгалийн үйл явц ямар чиглэлд гарч болохыг зааж өгөөгүй болно. Эхний зарчмын үүднээс авч үзвэл эрчим хүчийг хадгалах, хувиргах хуультай зөрчилдөхгүй аливаа төсөөлөх үйл явцыг байгальд хэрэгжүүлж болно. Жишээлбэл, температур нь өөр өөр хоёр биетэй бол термодинамикийн нэгдүгээр хуулийн дагуу бага температуртай биетээс өндөр температуртай биет рүү дулааны шилжих нь хоорондоо зөрчилдөхгүй. Энэ процесст эхний эхлэлээс тавьсан цорын ганц хязгаарлалт бол нэг биеэс ялгарах дулааны хэмжээ нь хоёр дахь хүлээн авсан дулааны хэмжээтэй тэнцүү байх явдал юм. Термодинамикийн хоёрдахь хууль нь бодит байдалд болж буй үйл явцын чиглэлийг дүгнэх боломжийг олгодог. Эхний зарчимтай хамт термодинамикийн тэнцвэрт байдалд байгаа биеийн янз бүрийн макроскопийн параметрүүдийн хооронд олон тооны тоон хамаарлыг бий болгох боломжийг олгодог. Термодинамикийн хоёрдугаар хуулийг үндэслэгч нь Францын инженер, физикч Сади Карно юм. Тэрээр дулааныг ажил болгох нөхцлийг судлав. Термодинамикийн хоёрдахь хуулийн томъёололд хүрэхийн тулд дулааны хөдөлгүүрийн ажиллагааг бүдүүвчилэн авч үзье. Ажлын явцад энэ нь олон дугуй процесс (мөчлөг) гүйцэтгэдэг. Дугуй үйл явц Энэ бол термодинамикийн процессын багц бөгөөд үүний үр дүнд систем анхны байдалдаа эргэж орно. Тойргийн процессыг төлөв байдлын диаграммд хаалттай шугамаар дүрслэв. Дотоод энергийн өөрчлөлт 0 байна. Шууд мөчлөг систем нь эерэг ажил хийдэг дугуй процесс гэж нэрлэдэг Q 1 байг - өргөтгөлийн үед систем хүлээн авсан дулааны хэмжээ (Зураг 43.1); Q 2 - шахсан үед систем бууж өгсөн; U 1 - эхний төлөв дэх системийн дотоод энерги, U 2 - хоёр дахь төлөв дэх системийн дотоод энерги. Тэлэх үед ажлын бодис халаагчаас дулааны Q 1-ийг хүлээн авч эерэг A 1 ажлыг гүйцэтгэдэг. Термодинамикийн нэгдүгээр хуулийн дагуу: Q 1 \u003d U 2 –U 1 + A 1. Шахсан үед ажлын бодис дээр ажил гүйцэтгэдэг БА 2 ба үүнтэй зэрэгцэн хөргөгчинд дулааны хэмжээг өгдөг Q 2: Q 2 \u003d U 1 –U 2 - A 2 Үүний үр дүнд: Q 1 - Q 2 \u003d A 1 –A 2 Тиймээс дулааны хөдөлгүүр нь шууд дугуй циклийг дуусгасан бөгөөд үүний үр дүнд халаагч Q 1 дулааныг гаргаж, хөргөгч Q 2 дулааныг хүлээн авав. Дулаан Q \u003d Q 1 - Q 2 ажил A \u003d A 1 –A 2 ажил руу явав. Дулааны хөдөлгүүрт гаднаас авсан Q 1 дулааныг бүгдийг нь ашигтай ажил хийхэд ашигладаггүй. Тиймээс дулааны хөдөлгүүр нь үр ашгаар тодорхойлогддог. Үр ашиг (h) нь нэг мөчлөгт гүйцэтгэсэн А ажлын мөчлөгт хүлээн авсан дулаантай харьцуулсан харьцаа юм. Өмнөх хэсгийн томъёоноос (1) үр ашиг нь харагдаж байна дулааны хөдөлгүүр нь нэгээс бага байна. Хамгийн сайн нь нэгтэй тэнцүү үр ашигтай машин байх болно. Ийм машин нь хөргөгчинд юу ч өгөхгүйгээр тодорхой биенээс авсан бүх дулааныг ажилд бүрэн хувиргаж чаддаг. Олон тооны туршилтууд ийм машин бүтээх боломжгүйг харуулсан. Энэхүү дүгнэлтийг анх Сади Карно 1824 онд гаргасан бөгөөд дулааны хөдөлгүүрүүдийн ажиллах нөхцлийг судалж үзээд дулааны хөдөлгүүртэй ажиллахад дор хаяж хоёр өөр температуртай дулааны эх үүсвэр шаардлагатай болохыг нотолжээ. Дараа нь үүнийг томъёолсон Р.Клаусиус (1850), В.Келвин (1852) нар нарийвчлан судлав термодинамикийн хоёрдахь хууль.
Үг хэлэх Клаузиус(1850): Дулаан системд ямар ч өөрчлөлтгүйгээр бага халсан биеэс илүү халсан биет рүү аяндаа шилжиж чадахгүй. Энэ бол процесс боломжгүй, цорын ганц эцсийн үр дүн нь бага халсан биеэс халсан биед дулаан хэлбэрээр энерги шилжүүлэх явдал юм. Энэ тодорхойлолтоос үл хамааран халаалт бага халаагуураас халсан биед дулааныг шилжүүлэх боломжгүй гэсэн үг биш юм. Дулааныг бага хөргөлтөөс аль ч хөргөлтийн станц дахь дулаан биед шилжүүлдэг боловч энэ нь үр дүнгээ өгдөг тул дулаан дамжуулах нь эцсийн үр дүн биш юм. Үг хэлэх Томсон (Келвин) (1851): Системийн төлөв байдалд өөр ямар ч өөрчлөлт оруулахгүйгээр жигд температуртай биенээс авсан бүх дулааныг ажилд хөрвүүлэх боломжгүй юм. Энэ бол процесс боломжгүй, цорын ганц эцсийн үр дүн нь тодорхой биеэс авсан бүх дулааныг түүнтэй дүйцэхүйц ажил болгон хувиргах явдал юм. Дулааныг бүрэн ажил болгох боломжгүй гэдгийг энд дагаж мөрдөхгүй. Жишээлбэл, изотермийн процесст (dU \u003d 0) дулааныг бүрэн ажил болгон хувиргадаг боловч энэ хий нь цорын ганц, эцсийн үр дүн биш юм. Дээрх томъёоллууд нь ижил утгатай болох нь харагдаж байна. Термодинамикийн хоёрдахь хуулийг системийн төлөв байдалд өөр ямар ч өөрчлөлт оруулалгүйгээр хүлээн авсан бүх дулааныг нь ажиллуулах хөдөлгүүрийг бий болгох гэсэн бүх оролдлого бүтэлгүйтсэн үед эцэслэн боловсруулсан болно. хоёр дахь төрлийн байнгын хөдөлгөөнт машин... Энэ бол үр ашигтай хөдөлгүүр юм. нэг зуу%. Тиймээс термодинамикийн хоёрдахь хуулийн өөр нэг томъёолол: хоёр дахь төрлийн үүрдийн хөдөлгөөнт хөдөлгөөн боломжгүй, өөрөөр хэлбэл. нэг усан сангаас дулааныг авч, энэ дулааныг бүрэн ажил болгох ийм үе үе ажилладаг хөдөлгүүр. Термодинамикийн хоёрдахь хууль нь бүх термодинамик процессыг хуваах боломжийг бидэнд олгодог буцаах боломжтой болон эргэлт буцалтгүй... Хэрэв аливаа үйл явцын үр дүнд систем муж улсаас дамждаг бол БА өөр В төлөвт оруулаад, боломжтой бол ядаж нэг хэлбэрээр анхны байдал руу нь буцааж өг БА Үүнээс гадна бусад бүх биед ямар ч өөрчлөлт гарахгүй тул энэ үйл явцыг буцаах гэж нэрлэдэг. Хэрэв үүнийг хийх боломжгүй бол процессыг эргэлт буцалтгүй гэж нэрлэдэг. Урагшаа болон урагшлах чиглэл нь ижил боломжтой бөгөөд тэнцүү байсан тохиолдолд буцаах процессыг хийж болно. Буцаах боломжтой процессууд нь маш бага хурдтай, хамгийн тохиромжтой хязгааргүй удаан явагдах процесс юм. Бодит нөхцөлд процессууд хязгаарлагдмал хурдтай явагддаг тул зөвхөн тодорхой нарийвчлалтайгаар буцаах боломжтой гэж үзэж болно. Үүний эсрэгээр эргэлт буцалтгүй байдал нь дулааны процессын мөн чанараас үүдэлтэй шинж чанар юм. Үл буцах процессын жишээ бол үрэлт, температурын хязгаарын зөрүү дэх дулаан дамжуулах процесс, уусалт, тархалтын процесс дагалддаг бүх процесс юм. Эдгээр бүх чиглэлүүд нэг чиглэлд аяндаа "өөрсдөө" явагддаг бөгөөд эдгээр процесс тус бүр эсрэг чиглэлд явагдахын тулд бусад нөхөн олговрын процессууд зэрэгцэн явагдах шаардлагатай болдог. Үүний үр дүнд дэлхийн нөхцөлд үйл явдлууд байгалийн жам ёсны чиглэлтэй байдаг. Термодинамикийн хоёрдахь хуультермодинамик процессын урсгалын чиглэлийг тодорхойлдог бөгөөд ингэснээр байгальд ямар процесс аяндаа үүсч болох вэ гэсэн асуултанд хариулт өгдөг. Энэ нь нэг хэлбэрийн энерги шилжүүлэх үйл явцыг эргэлт буцалтгүй болгохыг зааж өгдөг. Ажил бол бүхэлдээ биеийн захиалгат хөдөлгөөний энергийг шилжүүлэх хэлбэр юм; дулаан нь эмх замбараагүй хөдөлгөөнийг эрчим хүч дамжуулах хэлбэр юм. Захиалгатай хөдөлгөөн нь аяндаа замбараагүй болж хувирдаг. Ажлыг гадны хүчээр гүйцэтгэсэн тохиолдолд л урвуу шилжилт боломжтой. Дулааны хөдөлгүүрүүдийн үйл ажиллагаанд дүн шинжилгээ хийж Карно хамгийн өндөр үр ашигтайгаар тодорхойлогддог тул хамгийн ашигтай процесс бол хоёр изотерм ба хоёр адиабатаас бүрдэх эргэлтэт дугуй процесс юм гэсэн дүгнэлтэд хүрсэн. Энэ мөчлөгийг Карногийн мөчлөг гэж нэрлэдэг. Карногийн мөчлөг- системийн гүйцэтгэсэн ажлыг хамгийн дээд хэмжээнд байлгах шууд дугуй процесс. Цикл нь хоёр изотермал (1®2 ба 3®4) ба хоёр адиабатик тэлэлт ба агшилтаас (2®3 ба 4®1) бүрдэнэ (Зураг 45.1). Карногийн мөчлөгийг гүйцэтгэдэг машиныг хамгийн тохиромжтой дулааны хөдөлгүүр гэж нэрлэдэг. Изотермийн өргөтгөлийн үеэр хийсэн ажил: Адиабатик өргөтгөлийн хувьд системийн дотоод энерги алдагдсанаас болж ажил хийгддэг Q \u003d 0: Изотермийн шахалтын дор систем дээр хийсэн ажил: Адиабат шахалтын ажил: А 2 \u003d –DU \u003d С V (Т 2 –Т 1). Хамгийн тохиромжтой дулааны хөдөлгүүрийн үр ашгийг тооцоолцгооё. Бид Пуассоны тэгшитгэлийг хоёр адиабат процесст бичдэг. Тэдний харьцааг авч үзвэл бид дараахь зүйлийг авна. Томъёогоор (3) томъёогоор багасгаж дараахь байдлаар бууруулна. Эндээс бид томъёолж байна карногийн анхны теорем: Карногийн эргэлтэт эргэлтийн үр ашиг нь ажлын шингэний шинж чанараас хамаардаггүй бөгөөд зөвхөн халаагч ба хөргөгчийн үнэмлэхүй температурын функц юм. Карногийн хоёр дахь теорем: халаагч ба хөргөгчийн температурын өгөгдсөн утгаар ажилладаг аливаа дулааны хөдөлгүүр нь халаагч ба хөргөгчний ижил температурт эргэх Карно циклийн дагуу ажилладаг машинаас өндөр үр ашигтэй байж чадахгүй. Дурын буцаах мөчлөгийн дулааны үр ашиг энд T max ба T min нь авч үзэж буй мөчлөгт оролцож буй халаагч ба хөргөгчийн хэт их температур юм. Үзэл баримтлал орноэхнийх нь Р.Клаузиус 1862 онд нэвтрүүлсэн. Төрийн функц S, дифференциал: гэж нэрлэдэг энтропи.Энд dQ - Анхан шатны буцаах процесст системд хязгааргүй бага хэмжээний дулаан дамжуулдаг, Т Системийн үнэмлэхүй температур. (2) илэрхийлэлийг нэгтгэж, бид дараахь зүйлийг авна. энд S 1 ба S 2 - 1 ба 2 муж дахь энтропийн утга, DS- буцаах процессын явцад энтропийн өөрчлөлт. Системийг 1-р төлөвөөс 2-р төлөв рүү шилжүүлдэг аливаа эргэлт буцалтгүй процесст энтропийн өөрчлөлт нь энэ процесст системд шилжүүлсэн дулааны бууралттай тэнцүү байна. Биеийн байдал бүр нь энтропийн тодорхой нэг утгатай тохирч байна. Тиймээс энтропи бол төрийн өвөрмөц функц юм. Биет утга нь энтропи өөрөө биш, зөвхөн энтропийн ялгаа юм. Клаузиус дараахь чухал саналуудыг олж авсан бөгөөд эдгээрийг бид нотолгоогүйгээр боловсруулсан болно. 1. Энтропи бол нэмэлт тоо хэмжээ: хэд хэдэн биений системийн энтропи бол бүх биеийн энтропийн нийлбэр юм. 2. Энтропийг зөвхөн дурын тогтмол хүртэл тодорхойлдог. 3. Хэрэв тусгаарлагдсан системд буцаах процессууд тохиолдвол түүний энтропи өөрчлөгдөхгүй хэвээр үлдэнэ. 4. Буцах боломжгүй үйл явцын үед тусгаарлагдсан системийн энтропи нэмэгддэг. Тусгаарлагдсан системийн энтропи ямар ч процессын явцад буурч чадахгүй. Математикийн хувьд эдгээр байрлалуудыг тэгш бус байдлын хэлбэрээр бичиж болно клаузиусын тэгш бус байдал: 5. Тэнцвэрт байгаа системийн энтропи хамгийн их байна. Байгаль дээр бүх бодит үйл явц эргэлт буцалтгүй байдаг. Тиймээс хязгаарлагдмал тусгаарлагдсан систем дэх бүх процессууд энтропийн өсөлтөд хүргэдэг гэж үзэж болно. Энэ бол энтропийг нэмэгдүүлэх зарчим юм. Дээр дурдсан зүйл дээр үндэслэн термодинамикийн хоёрдахь хуулийг дараахь байдлаар томъёолж болно. тусгаарлагдсан системүүдэд зөвхөн энтропи буурахгүй байх ийм процессууд л боломжтой байдаг. Хэрэв процессууд буцаах боломжтой бол тогтмол, хэрэв эргэлт буцалтгүй бол нэмэгддэг. Хэрэв систем нь тусгаарлагдаагүй бол түүний энтропи нь дур зоргоороо авирлаж болно. Хэрэв систем дулаан ялгаруулдаг бол (DQ.)<0), то ее энтропия убывает. Если такая система совершает замкнутый цикл, то энтропия в конце цикла буде равна исходному значению, то есть ее изменение равно нулю. Однако на разных этапах энтропия может и убывать, и возрастать, но так, что сумма всех изменений энтропии равно нулю. Сэдэв 9. Молекул-кинетик онол Молекул кинетик онолыг ашигладаг хамгийн тохиромжтой загвархамгийн тохиромжтой хий, Үүний дагуу: 1) хийн молекулуудын дотоод эзэлхүүн нь савны эзэлхүүнтэй харьцуулахад ач холбогдолгүй юм; 2) хийн молекулуудын хоорондох харилцан үйлчлэлийн хүч байхгүй; 3) хийн молекулууд хоорондоо ба савны ханатай мөргөлдөх нь туйлын уян хатан шинж чанартай байдаг. Хийн хувьд молекулууд ихэнхдээ хоорондоо хол зайтай байдаг тул тэдгээрийн харилцан үйлчлэлийн хүч нь бараг тэг байдаг. Хийн молекулуудын кинетик энерги нь боломжит хэмжээнээс хамаагүй өндөр гэж үзэж болох тул сүүлийг нь үл тоомсорлож болно. Молекулын физик ба термодинамикийн хувьд хийн төлөв нь гурван макропараметрийн хослолоор тодорхойлогддог p, V, T төлөвийн параметрүүд гэж нэрлэдэг. Температур нь зөвхөн термодинамикт төдийгүй ерөнхийдөө физикт чухал үүрэг гүйцэтгэдэг үндсэн ойлголтуудын нэг юм. Температур - макроскопийн системийн термодинамикийн тэнцвэрийн байдлыг тодорхойлдог физик хэмжигдэхүүн. Жин ба хэмжлийн XI Ерөнхий бага хурлын шийдвэрийн дагуу (1960) одоогоор термодинамик ба олон улсын практик хоёр температурын хэмжүүрийг л ашиглаж болно. ,
Келвин (К) ба Цельсийн (° C) градус тус тус төгссөн. Олон улсын практик хэмжүүрт 1.013 10 сек Па даралттай усны хөлдөлт ба буцалгах цэгийг O ба 100 ° C (эхний цэгүүд) тус тус тооцдог. Даралт SI-д үүнийг Па (паскал) -аар хэмждэг: 1N / m 2 \u003d 1 Pa. Системийн бус даралтын нэгжийг ихэвчлэн ашигладаг: 1 мм м.у.б. Урлаг. \u003d 133.3 Па; техникийн уур амьсгал 1 at \u003d 750 mm Hg Урлаг. »10 5 Па; хэвийн (физик) агаар мандал: 1 атм \u003d 760 мм м.у.б. ”1.013. 10 5 Па. Хийн кинетик онолын гол тэгшитгэл нь даралтыг (туршилтаар хэмжсэн хэмжигдэхүүн) хийн молекулын хурд буюу кинетик энергитэй холбодог харилцаа юм. Энэ илэрхийлэлийг дууддаг идеал хийнүүдийн молекул кинетик онолын үндсэн тэгшитгэл. Энэ тэгшитгэл нь даралт ба хурдны хоорондох хамаарлыг тогтоож өгдөг. Ингээд танилцуулъя Энэ тэгшитгэлд даралт нь молекулуудын орчуулгын дундаж энергитэй холбоотой байдаг. Хийн даралт нь нэгж эзэлхүүн дэх молекулуудын шилжилт хөдөлгөөний хөдөлгөөний дундаж кинетик энергийн 2/3 тоотой тэнцүү байна. Хийн хамгийн тохиромжтой даралт нь дараахь харьцаатай температуртай холбоотой байдаг. Даралтыг зөвхөн концентрацаар (тогтмол температурт) тодорхойлдог бөгөөд молекулын төрлөөс хамаардаггүй. Хэрэв бидэнд хэд хэдэн хийн холимог байгаа бол тэдгээрийн молекулын концентраци n 1, n 2, ..., n i болон Даралтуудыг хэсэгчилсэн даралт гэж нэрлэдэг. Жишээлбэл, p 1 - хэсэгчилсэн даралт нь бүх эзэлхүүнийг эзэлсэн тохиолдолд хольц дахь эхний хий үүсэх даралттай тохирч байна. Дагуу далтоны хууль хамгийн тохиромжтой хийн хувьд Тиймээс хийн хольцын нөлөөгөөр савны хананд үзүүлэх даралт нь хольцын бие даасан хэсгүүдийн хэсэгчилсэн даралтын нийлбэртэй тэнцүү байна.![]() (1)
(1) ; тэдгээр.
; тэдгээр.  (2)
(2) ;
;  (3)
(3) Адиабат ба изотермийн процессуудыг харьцуулж үзэхэд адиабат нь изотермээс илүү огцом явагддаг болохыг харж болно. pV\u003d const, адиабатын хувьд
Адиабат ба изотермийн процессуудыг харьцуулж үзэхэд адиабат нь изотермээс илүү огцом явагддаг болохыг харж болно. pV\u003d const, адиабатын хувьд  ба g\u003e 1, өөрөөр хэлбэл адиабат процесст үзүүлэх даралт илүү хүчтэй хамаарна.
ба g\u003e 1, өөрөөр хэлбэл адиабат процесст үзүүлэх даралт илүү хүчтэй хамаарна. ... Дугуй үйл явцын эхний эхлэл нь:
... Дугуй үйл явцын эхний эхлэл нь:  .
. ... Шууд мөчлөгийг харуулсан диаграмм дахь хаалттай муруйг цагийн зүүний дагуу дүрсэлсэн болно. Системийг мөчлөгт эерэг ажил гүйцэтгэхийн тулд өргөтгөл шахалтаас илүү өндөр даралттай байх шаардлагатай.
... Шууд мөчлөгийг харуулсан диаграмм дахь хаалттай муруйг цагийн зүүний дагуу дүрсэлсэн болно. Системийг мөчлөгт эерэг ажил гүйцэтгэхийн тулд өргөтгөл шахалтаас илүү өндөр даралттай байх шаардлагатай. (1)
(1) Хэрэв дугуй хэлбэрийн процесст хий нь өргөжиж байгаа бол шахалтын явцад гадны хүчээр үүсгэгдсэнээс бага ажил хийдэг, өөрөөр хэлбэл. A 1<
А 2, ийм мөчлөгийг урвуу гэж нэрлэдэг. Энэ нь хийн өргөтгөл нь шахалтаас бага температурт тохиолддог үед тохиолдож болно. Энэ тохиолдолд хий нь тэлэлтийн явцад хүлээн авснаас илүү их дулааныг өгдөг. Урвуу эргэлттэй машинуудыг хөргөлтийн машин гэж нэрлэдэг. Хөргөгч машинуудад дулааныг хүйтэн биеэс халуунд шилжүүлэх явцад гадны хүчний зардлыг шаарддаг (A 2 -A 1). Диаграмм дээр урвуу мөчлөгийг цагийн зүүний дагуу туулсан хаалттай муруй хэлбэрээр дүрслэв. Зураг дээр. 43.2 нь дулааны хөдөлгүүр ба хөргөлтийн машины ажиллагааны зарчмуудыг бүдүүвч байдлаар харуулсан болно.
Хэрэв дугуй хэлбэрийн процесст хий нь өргөжиж байгаа бол шахалтын явцад гадны хүчээр үүсгэгдсэнээс бага ажил хийдэг, өөрөөр хэлбэл. A 1<
А 2, ийм мөчлөгийг урвуу гэж нэрлэдэг. Энэ нь хийн өргөтгөл нь шахалтаас бага температурт тохиолддог үед тохиолдож болно. Энэ тохиолдолд хий нь тэлэлтийн явцад хүлээн авснаас илүү их дулааныг өгдөг. Урвуу эргэлттэй машинуудыг хөргөлтийн машин гэж нэрлэдэг. Хөргөгч машинуудад дулааныг хүйтэн биеэс халуунд шилжүүлэх явцад гадны хүчний зардлыг шаарддаг (A 2 -A 1). Диаграмм дээр урвуу мөчлөгийг цагийн зүүний дагуу туулсан хаалттай муруй хэлбэрээр дүрслэв. Зураг дээр. 43.2 нь дулааны хөдөлгүүр ба хөргөлтийн машины ажиллагааны зарчмуудыг бүдүүвч байдлаар харуулсан болно. ; A 1 \u003d Q 1. (1)
; A 1 \u003d Q 1. (1) .
. ; A 2 \u003d Q 2. (2)
; A 2 \u003d Q 2. (2) (3)
(3) .
. .
.
 .
.
 (2)
(2) ,
, (3)
(3) (3)
(3) Нэг молекулын эмх замбараагүй орчуулах хөдөлгөөний дундаж кинетик энерги мөн үү гэвэл үндсэн тэгшитгэлийг дараах байдлаар бичнэ.
Нэг молекулын эмх замбараагүй орчуулах хөдөлгөөний дундаж кинетик энерги мөн үү гэвэл үндсэн тэгшитгэлийг дараах байдлаар бичнэ.  эсвэл
эсвэл 
 .
. дараа нь.
дараа нь. .
. Молекулын физик ба термодинамик нь тэдний хандлагын хувьд үндсэндээ хоёр өөр боловч хоорондоо нягт уялдаатай шинжлэх ухаанууд нэг зүйлтэй харьцдаг - физик системийн макроскоп шинж чанарыг судлах боловч огт өөр аргуудтай
Молекулын физик ба термодинамик нь тэдний хандлагын хувьд үндсэндээ хоёр өөр боловч хоорондоо нягт уялдаатай шинжлэх ухаанууд нэг зүйлтэй харьцдаг - физик системийн макроскоп шинж чанарыг судлах боловч огт өөр аргуудтай Молекулын физик Молекулын физик буюу молекул кинетик онол нь бодисын бүтцийн талаархи тодорхой санаанууд дээр тулгуурладаг. - Олон тооны тоосонцороос бүрдэх макроскопын системийн зан үйлийн хуулийг бий болгохын тулд молекулын физик нь бодисын янз бүрийн загвар, жишээлбэл, хамгийн тохиромжтой хийн загварыг ашигладаг. Молекулын физик бол статистикийн онол, физик, өөрөөр хэлбэл магадлалын загвар дээр үндэслэсэн асар олон тооны бөөмс (атом, молекул) -аас бүрдсэн системийн зан үйлийг авч үздэг онол юм. Энэ нь статистик хандлагын үндсэн дээр туршилтаар хэмжсэн макроскопийн хэмжигдэхүүн (даралт, эзэлхүүн, температур г.м.) ба системийн микроскоп шинж чанарт багтсан бөөмсийн микроскоп шинж чанаруудын утга (масс, импульс, энерги гэх мэт) хооронд холбоо тогтоохыг эрмэлздэг. ...
Молекулын физик Молекулын физик буюу молекул кинетик онол нь бодисын бүтцийн талаархи тодорхой санаанууд дээр тулгуурладаг. - Олон тооны тоосонцороос бүрдэх макроскопын системийн зан үйлийн хуулийг бий болгохын тулд молекулын физик нь бодисын янз бүрийн загвар, жишээлбэл, хамгийн тохиромжтой хийн загварыг ашигладаг. Молекулын физик бол статистикийн онол, физик, өөрөөр хэлбэл магадлалын загвар дээр үндэслэсэн асар олон тооны бөөмс (атом, молекул) -аас бүрдсэн системийн зан үйлийг авч үздэг онол юм. Энэ нь статистик хандлагын үндсэн дээр туршилтаар хэмжсэн макроскопийн хэмжигдэхүүн (даралт, эзэлхүүн, температур г.м.) ба системийн микроскоп шинж чанарт багтсан бөөмсийн микроскоп шинж чанаруудын утга (масс, импульс, энерги гэх мэт) хооронд холбоо тогтоохыг эрмэлздэг. ... Термодинамик Молекулын кинетик онолоос ялгаатай нь термодинамик нь макроскопийн системийн термодинамикийн шинж чанарыг судлахдаа бодисын молекулын бүтцийн талаар ямар ч санаа бодолд найддаггүй. Термодинамик бол феноменологийн шинжлэх ухаан юм. - Тэрээр бодисын шинж чанаруудын талаар эрчим хүчийг хадгалах хууль гэх мэт туршлагаар тогтоосон хуулиуд дээр үндэслэн дүгнэлт хийдэг. Термодинамик нь зөвхөн физик туршилтын үндсэн дээр нэвтрүүлсэн макроскоп хэмжигдэхүүн (даралт, температур, эзэлхүүн гэх мэт) -тэй ажилладаг.
Термодинамик Молекулын кинетик онолоос ялгаатай нь термодинамик нь макроскопийн системийн термодинамикийн шинж чанарыг судлахдаа бодисын молекулын бүтцийн талаар ямар ч санаа бодолд найддаггүй. Термодинамик бол феноменологийн шинжлэх ухаан юм. - Тэрээр бодисын шинж чанаруудын талаар эрчим хүчийг хадгалах хууль гэх мэт туршлагаар тогтоосон хуулиуд дээр үндэслэн дүгнэлт хийдэг. Термодинамик нь зөвхөн физик туршилтын үндсэн дээр нэвтрүүлсэн макроскоп хэмжигдэхүүн (даралт, температур, эзэлхүүн гэх мэт) -тэй ажилладаг. Термодинамик ба статистикийн хоёр хандлага нь хоорондоо зөрчилдөхгүй боловч бие биенээ нөхөж байдаг. Зөвхөн термодинамик ба молекул кинетик онолыг хослуулан хэрэглэснээр олон тооны бөөмөөс бүрдэх системийн шинж чанаруудын бүрэн дүр зургийг гаргаж болно.
Термодинамик ба статистикийн хоёр хандлага нь хоорондоо зөрчилдөхгүй боловч бие биенээ нөхөж байдаг. Зөвхөн термодинамик ба молекул кинетик онолыг хослуулан хэрэглэснээр олон тооны бөөмөөс бүрдэх системийн шинж чанаруудын бүрэн дүр зургийг гаргаж болно. Молекулын физик Молекул кинетик онол нь химийн бодисын хамгийн жижиг хэсгүүд болох атом ба молекулуудын оршин тогтнох үзэл баримтлал дээр үндэслэн бодисын бүтэц, шинж чанарыг судлах явдал юм.
Молекулын физик Молекул кинетик онол нь химийн бодисын хамгийн жижиг хэсгүүд болох атом ба молекулуудын оршин тогтнох үзэл баримтлал дээр үндэслэн бодисын бүтэц, шинж чанарыг судлах явдал юм. Молекул-кинетикийн онол MKT-ийн үндсэн зарчмууд 1. Бүх бодисууд - шингэн, хатуу ба хий - хамгийн жижиг хэсгүүд болох молекулуудаас бүрддэг бөгөөд эдгээр нь өөрөө атом ("анхан шатны молекул") -аас бүрддэг. Химийн бодисын молекулууд нь энгийн эсвэл төвөгтэй байж болно, өөрөөр хэлбэл нэг буюу хэд хэдэн атомоос бүрддэг. Молекулууд ба атомууд нь цахилгаан төвийг сахисан тоосонцор юм. Тодорхой нөхцөлд молекулууд ба атомууд нэмэлт цахилгаан цэнэг авч эерэг ба сөрөг ион болж хувирдаг. 2. Атом ба молекулууд тасралтгүй эмх замбараагүй хөдөлгөөнд байдаг бөгөөд үүнийг дулааны хөдөлгөөн гэнэ 3. Бөөмсүүд хоорондоо цахилгаан шинж чанартай хүчээр харилцан үйлчилдэг. Бөөмс хоорондын таталцлын харилцан үйлчлэл нь ач холбогдолгүй юм.
Молекул-кинетикийн онол MKT-ийн үндсэн зарчмууд 1. Бүх бодисууд - шингэн, хатуу ба хий - хамгийн жижиг хэсгүүд болох молекулуудаас бүрддэг бөгөөд эдгээр нь өөрөө атом ("анхан шатны молекул") -аас бүрддэг. Химийн бодисын молекулууд нь энгийн эсвэл төвөгтэй байж болно, өөрөөр хэлбэл нэг буюу хэд хэдэн атомоос бүрддэг. Молекулууд ба атомууд нь цахилгаан төвийг сахисан тоосонцор юм. Тодорхой нөхцөлд молекулууд ба атомууд нэмэлт цахилгаан цэнэг авч эерэг ба сөрөг ион болж хувирдаг. 2. Атом ба молекулууд тасралтгүй эмх замбараагүй хөдөлгөөнд байдаг бөгөөд үүнийг дулааны хөдөлгөөн гэнэ 3. Бөөмсүүд хоорондоо цахилгаан шинж чанартай хүчээр харилцан үйлчилдэг. Бөөмс хоорондын таталцлын харилцан үйлчлэл нь ач холбогдолгүй юм. Молекул кинетик онол Атом ба молекулын санамсаргүй хөдөлгөөний молекул кинетик онолын үзэл баримтлалын хамгийн гайхалтай туршилтын баталгаа бол Броуны хөдөлгөөн юм. Броунийн хөдөлгөөн гэдэг нь шингэн эсвэл хийнд түдгэлзсэн бичил жижиг хэсгүүдийн дулааны хөдөлгөөн юм. Үүнийг 1827 онд Английн ботаникч Р.Браун нээжээ.Молекулуудын санамсаргүй мөргөлдөх нөлөөн дор броун тоосонцор хөдөлдөг. Молекулуудын эмх замбараагүй дулааны хөдөлгөөнөөс болж эдгээр нөлөөлөл хэзээ ч бие биенээ тэнцвэржүүлдэггүй. Үүний үр дүнд Броуны бөөмийн хурд нь хэмжээ, чиглэлээрээ санамсаргүй байдлаар өөрчлөгдөж, түүний замнал нь нарийн зигзаг муруй болно (Зураг). Броунийн хөдөлгөөний онолыг А.Эйнштейн 1905 онд бүтээсэн бөгөөд Эйнштейний онолыг Францын физикч Ж.Перриний 1908-1919 онд явуулсан туршилтаар баталжээ.
Молекул кинетик онол Атом ба молекулын санамсаргүй хөдөлгөөний молекул кинетик онолын үзэл баримтлалын хамгийн гайхалтай туршилтын баталгаа бол Броуны хөдөлгөөн юм. Броунийн хөдөлгөөн гэдэг нь шингэн эсвэл хийнд түдгэлзсэн бичил жижиг хэсгүүдийн дулааны хөдөлгөөн юм. Үүнийг 1827 онд Английн ботаникч Р.Браун нээжээ.Молекулуудын санамсаргүй мөргөлдөх нөлөөн дор броун тоосонцор хөдөлдөг. Молекулуудын эмх замбараагүй дулааны хөдөлгөөнөөс болж эдгээр нөлөөлөл хэзээ ч бие биенээ тэнцвэржүүлдэггүй. Үүний үр дүнд Броуны бөөмийн хурд нь хэмжээ, чиглэлээрээ санамсаргүй байдлаар өөрчлөгдөж, түүний замнал нь нарийн зигзаг муруй болно (Зураг). Броунийн хөдөлгөөний онолыг А.Эйнштейн 1905 онд бүтээсэн бөгөөд Эйнштейний онолыг Францын физикч Ж.Перриний 1908-1919 онд явуулсан туршилтаар баталжээ. Молекул кинетикийн онол Бодисын молекулуудын байнгын эмх замбараагүй хөдөлгөөн нь бас амархан ажиглагддаг өөр нэг үзэгдэл болох диффузид илэрдэг. Диффуз нь бие биенээсээ хоёр ба түүнээс дээш холбоо барих бодис нэвтрэх үзэгдэл юм. - Хийн найрлага нь олон янз байдаг бол хий нь хамгийн хурдан явагддаг. Тархалт нь бүрэлдэхүүн хэсгүүдийн нягтралаас үл хамааран нэгэн төрлийн холимог үүсгэдэг. Тиймээс, хэрэв хүчилтөрөгч O 2 ба устөрөгч H 2 нь савны хоёр хэсэгт хуваагдан тусгаарлагдсан байвал хуваалтыг авсны дараа бусад хийн харилцан нэвтрэлт үйл явц эхэлж, тэсрэх холимог болох тэсрэх хий үүснэ. Энэ процесс нь хөнгөн хий (устөрөгч) савны дээд хагаст, хүнд (хүчилтөрөгч) доод хэсэгт байх үед бас тохиолддог.
Молекул кинетикийн онол Бодисын молекулуудын байнгын эмх замбараагүй хөдөлгөөн нь бас амархан ажиглагддаг өөр нэг үзэгдэл болох диффузид илэрдэг. Диффуз нь бие биенээсээ хоёр ба түүнээс дээш холбоо барих бодис нэвтрэх үзэгдэл юм. - Хийн найрлага нь олон янз байдаг бол хий нь хамгийн хурдан явагддаг. Тархалт нь бүрэлдэхүүн хэсгүүдийн нягтралаас үл хамааран нэгэн төрлийн холимог үүсгэдэг. Тиймээс, хэрэв хүчилтөрөгч O 2 ба устөрөгч H 2 нь савны хоёр хэсэгт хуваагдан тусгаарлагдсан байвал хуваалтыг авсны дараа бусад хийн харилцан нэвтрэлт үйл явц эхэлж, тэсрэх холимог болох тэсрэх хий үүснэ. Энэ процесс нь хөнгөн хий (устөрөгч) савны дээд хагаст, хүнд (хүчилтөрөгч) доод хэсэгт байх үед бас тохиолддог. Молекул кинетик онол - Шингэн дэх ижил төстэй үйл явц илүү удаан явагддаг. Ялгаатай шингэний хоёр шингэнийг хооронд нь нэвтрүүлэх, шингэн дэх хатуу бодисыг уусгах (жишээлбэл, усан дахь элсэн чихэр) ба нэгэн төрлийн уусмал үүсэх нь шингэн дэх тархалтын процессын жишээ юм. Бодит нөхцөлд шингэн ба хийн дэхь диффузийг илүү хурдан холих процессоор далдалдаг, жишээлбэл конвекцийн урсгал үүссэнтэй холбоотой.
Молекул кинетик онол - Шингэн дэх ижил төстэй үйл явц илүү удаан явагддаг. Ялгаатай шингэний хоёр шингэнийг хооронд нь нэвтрүүлэх, шингэн дэх хатуу бодисыг уусгах (жишээлбэл, усан дахь элсэн чихэр) ба нэгэн төрлийн уусмал үүсэх нь шингэн дэх тархалтын процессын жишээ юм. Бодит нөхцөлд шингэн ба хийн дэхь диффузийг илүү хурдан холих процессоор далдалдаг, жишээлбэл конвекцийн урсгал үүссэнтэй холбоотой. Молекул кинетик онол - Хамгийн удаан тархах процесс нь хатуу биетүүдэд явагддаг. Гэсэн хэдий ч туршилтуудаас харахад удаан хугацааны дараа хоёр металлын сайн цэвэрлэсэн гадаргуутай хатуу шүргэлцэх тусам өөр металлын атомууд олддог болохыг харуулж байна. Диффуз ба броун хөдөлгөөн - Диффуз ба броун хөдөлгөөн нь хоорондоо холбоотой үзэгдэл юм. Молекулуудын эмх замбараагүй дулааны хөдөлгөөнөөс болж бие биенээсээ холбоо барих бодисын харилцан нэвтрэлт ба шингэн эсвэл хийнд түдгэлзсэн хамгийн жижиг хэсгүүдийн санамсаргүй хөдөлгөөн үүсдэг.
Молекул кинетик онол - Хамгийн удаан тархах процесс нь хатуу биетүүдэд явагддаг. Гэсэн хэдий ч туршилтуудаас харахад удаан хугацааны дараа хоёр металлын сайн цэвэрлэсэн гадаргуутай хатуу шүргэлцэх тусам өөр металлын атомууд олддог болохыг харуулж байна. Диффуз ба броун хөдөлгөөн - Диффуз ба броун хөдөлгөөн нь хоорондоо холбоотой үзэгдэл юм. Молекулуудын эмх замбараагүй дулааны хөдөлгөөнөөс болж бие биенээсээ холбоо барих бодисын харилцан нэвтрэлт ба шингэн эсвэл хийнд түдгэлзсэн хамгийн жижиг хэсгүүдийн санамсаргүй хөдөлгөөн үүсдэг. Молекул кинетик онол Хоёр молекулын хоорондох хүч, хоёр молекулын хоорондох хүч нь тэдгээрийн хоорондын зайгаас хамаарна. Молекулууд нь эерэг ба сөрөг цэнэгүүдийг агуулсан орон зайн нарийн төвөгтэй бүтэц юм. Хэрэв молекулуудын хоорондох зай хангалттай байвал молекул хоорондын таталцлын хүч давамгайлна. Бага зайд зэвүүн хүч давамгайлдаг.
Молекул кинетик онол Хоёр молекулын хоорондох хүч, хоёр молекулын хоорондох хүч нь тэдгээрийн хоорондын зайгаас хамаарна. Молекулууд нь эерэг ба сөрөг цэнэгүүдийг агуулсан орон зайн нарийн төвөгтэй бүтэц юм. Хэрэв молекулуудын хоорондох зай хангалттай байвал молекул хоорондын таталцлын хүч давамгайлна. Бага зайд зэвүүн хүч давамгайлдаг. Молекул кинетик онол r \u003d r 0 зайд харилцан үйлчлэх хүч алга болно. Энэ зайг уламжлалт байдлаар молекулын диаметр болгон авч болно. R \u003d r 0-ийн харилцан үйлчлэлийн энерги хамгийн бага байна. R 0 зайд хоёр молекулыг бие биенээсээ зайлуулахын тулд тэдэнд нэмэлт энерги 0. 0 өгөх шаардлагатай. E 0-ийн утгыг боломжит худгийн гүн буюу холбох энерги гэж нэрлэдэг. Молекулууд нь маш жижиг юм. Энгийн моноатомийн молекулууд нь ойролцоогоор 10-10 м хэмжээтэй байдаг.Цогц атомын молекулууд хэдэн зуу, мянга дахин том байж болно.
Молекул кинетик онол r \u003d r 0 зайд харилцан үйлчлэх хүч алга болно. Энэ зайг уламжлалт байдлаар молекулын диаметр болгон авч болно. R \u003d r 0-ийн харилцан үйлчлэлийн энерги хамгийн бага байна. R 0 зайд хоёр молекулыг бие биенээсээ зайлуулахын тулд тэдэнд нэмэлт энерги 0. 0 өгөх шаардлагатай. E 0-ийн утгыг боломжит худгийн гүн буюу холбох энерги гэж нэрлэдэг. Молекулууд нь маш жижиг юм. Энгийн моноатомийн молекулууд нь ойролцоогоор 10-10 м хэмжээтэй байдаг.Цогц атомын молекулууд хэдэн зуу, мянга дахин том байж болно. Молекул кинетик онол Температур нэмэгдэхийн хэрээр дулааны хөдөлгөөний кинетик энерги нэмэгддэг Бага температурт молекулын дундаж кинетик энерги нь боломжит худгийн гүнээс бага байж болно 0. Энэ тохиолдолд молекулууд шингэн буюу хатуу бодисонд өтгөрдөг; энэ тохиолдолд молекулуудын хоорондох дундаж зай ойролцоогоор r 0-тэй тэнцүү байх болно Температур өсөхөд молекулын дундаж кинетик энерги нь E 0-ээс их болж, молекулууд хоорондоо нисч, хийн бодис үүсдэг.
Молекул кинетик онол Температур нэмэгдэхийн хэрээр дулааны хөдөлгөөний кинетик энерги нэмэгддэг Бага температурт молекулын дундаж кинетик энерги нь боломжит худгийн гүнээс бага байж болно 0. Энэ тохиолдолд молекулууд шингэн буюу хатуу бодисонд өтгөрдөг; энэ тохиолдолд молекулуудын хоорондох дундаж зай ойролцоогоор r 0-тэй тэнцүү байх болно Температур өсөхөд молекулын дундаж кинетик энерги нь E 0-ээс их болж, молекулууд хоорондоо нисч, хийн бодис үүсдэг. Молекул кинетик онол Бодисын агрегат төлөв Хатуу биетэд молекулууд тогтмол төвүүдийн (тэнцвэрийн байрлал) орчим хатуу биетүүдэд санамсаргүй чичиргээ хийдэг. Эдгээр төвүүд орон зайд жигд бус хэлбэрээр байрлаж болно (хэлбэр дүрсгүй биетүүд) эсвэл захиалсан хэмжээст байгууламж (талст биетүүд) үүсгэдэг. Тиймээс хатуу биетүүд хэлбэр, эзэлхүүнээ хоёуланг нь хадгалдаг.
Молекул кинетик онол Бодисын агрегат төлөв Хатуу биетэд молекулууд тогтмол төвүүдийн (тэнцвэрийн байрлал) орчим хатуу биетүүдэд санамсаргүй чичиргээ хийдэг. Эдгээр төвүүд орон зайд жигд бус хэлбэрээр байрлаж болно (хэлбэр дүрсгүй биетүүд) эсвэл захиалсан хэмжээст байгууламж (талст биетүүд) үүсгэдэг. Тиймээс хатуу биетүүд хэлбэр, эзэлхүүнээ хоёуланг нь хадгалдаг. Молекул-кинетикийн онол Бодисын агрегат төлөв байдал Шингэний хувьд молекулууд дулааны хөдөлгөөнд илүү их эрх чөлөөтэй байдаг. Эдгээр нь тодорхой төвүүдтэй холбоогүй бөгөөд эзлэхүүн даяар хөдөлж чаддаг. Энэ нь шингэний шингэнийг тайлбарладаг. Ойролцоо зайтай шингэн молекулууд нь хэд хэдэн молекул агуулсан захиалсан бүтэц үүсгэж болно. Энэ үзэгдлийг талст биетүүдийн урт хугацааны эрэмбийн шинж чанараас ялгаатай нь богино хугацааны дараалал гэж нэрлэдэг. Тиймээс шингэн нь хэлбэрээ хадгалдаггүй, харин эзэлхүүнээ хадгалдаг
Молекул-кинетикийн онол Бодисын агрегат төлөв байдал Шингэний хувьд молекулууд дулааны хөдөлгөөнд илүү их эрх чөлөөтэй байдаг. Эдгээр нь тодорхой төвүүдтэй холбоогүй бөгөөд эзлэхүүн даяар хөдөлж чаддаг. Энэ нь шингэний шингэнийг тайлбарладаг. Ойролцоо зайтай шингэн молекулууд нь хэд хэдэн молекул агуулсан захиалсан бүтэц үүсгэж болно. Энэ үзэгдлийг талст биетүүдийн урт хугацааны эрэмбийн шинж чанараас ялгаатай нь богино хугацааны дараалал гэж нэрлэдэг. Тиймээс шингэн нь хэлбэрээ хадгалдаггүй, харин эзэлхүүнээ хадгалдаг Молекул кинетик онол Бодисын агрегат төлөв Хийн хувьд молекулуудын хоорондын зай ихэвчлэн хэмжээнээсээ хамаагүй их байдаг. Ийм том зайд байгаа молекулуудын харилцан үйлчлэлийн хүч бага бөгөөд молекул бүр өөр молекултай эсвэл судасны ханатай мөргөлдөх хүртэл шулуун шугамаар хөдөлдөг. - Ердийн нөхцөлд агаарын молекулуудын хоорондох дундаж зай ойролцоогоор 10-8 м, өөрөөр хэлбэл молекулын хэмжээнээс хэдэн арав дахин их байдаг. Молекулуудын хоорондын сул харилцан үйлчлэл нь хийнүүд өргөжиж, савны бүх эзэлхүүнийг дүүргэх чадварыг тайлбарладаг. Хязгаарлалтад харилцан үйлчлэл тэг болох хандлагатай байх үед бид хамгийн тохиромжтой хий гэсэн санааг олж авдаг. Тиймээс хий нь хэлбэр, эзэлхүүнээ хадгалдаггүй.
Молекул кинетик онол Бодисын агрегат төлөв Хийн хувьд молекулуудын хоорондын зай ихэвчлэн хэмжээнээсээ хамаагүй их байдаг. Ийм том зайд байгаа молекулуудын харилцан үйлчлэлийн хүч бага бөгөөд молекул бүр өөр молекултай эсвэл судасны ханатай мөргөлдөх хүртэл шулуун шугамаар хөдөлдөг. - Ердийн нөхцөлд агаарын молекулуудын хоорондох дундаж зай ойролцоогоор 10-8 м, өөрөөр хэлбэл молекулын хэмжээнээс хэдэн арав дахин их байдаг. Молекулуудын хоорондын сул харилцан үйлчлэл нь хийнүүд өргөжиж, савны бүх эзэлхүүнийг дүүргэх чадварыг тайлбарладаг. Хязгаарлалтад харилцан үйлчлэл тэг болох хандлагатай байх үед бид хамгийн тохиромжтой хий гэсэн санааг олж авдаг. Тиймээс хий нь хэлбэр, эзэлхүүнээ хадгалдаггүй. Молекул кинетик онол Бодисын хэмжээ Молекул кинетикийн онолд бодисын хэмжээг бодисын тоосонцрын тоотой пропорциональ гэж үздэг. Бодисын хэмжигдэхүүний нэгжийг мэнгэ (моль) гэж нэрлэдэг. Мэнгэ гэдэг нь 0, 012 кг нүүрстөрөгч 12 С-тэй тэнцүү тооны тоосонцор (молекул) агуулсан бодисын хэмжээг хэлнэ. (Нүүрстөрөгчийн молекул нь нэг атомаас бүрдэнэ) Тиймээс аливаа бодисын нэг мэнгэ ижил тооны бөөм (молекул) агуулдаг. ). Энэ тоог Авогадро тогтмол NA гэж нэрлэдэг: NA \u003d 6, 02 · 1023 моль - 1. Авогадрогийн тогтмол бол молекул кинетикийн онолын хамгийн чухал тогтмолуудын нэг юм.
Молекул кинетик онол Бодисын хэмжээ Молекул кинетикийн онолд бодисын хэмжээг бодисын тоосонцрын тоотой пропорциональ гэж үздэг. Бодисын хэмжигдэхүүний нэгжийг мэнгэ (моль) гэж нэрлэдэг. Мэнгэ гэдэг нь 0, 012 кг нүүрстөрөгч 12 С-тэй тэнцүү тооны тоосонцор (молекул) агуулсан бодисын хэмжээг хэлнэ. (Нүүрстөрөгчийн молекул нь нэг атомаас бүрдэнэ) Тиймээс аливаа бодисын нэг мэнгэ ижил тооны бөөм (молекул) агуулдаг. ). Энэ тоог Авогадро тогтмол NA гэж нэрлэдэг: NA \u003d 6, 02 · 1023 моль - 1. Авогадрогийн тогтмол бол молекул кинетикийн онолын хамгийн чухал тогтмолуудын нэг юм. Молекул кинетик онол a бодисын хэмжээ нь бодисын N ширхэг тоосонцор (молекул) -ыг Авогадрогийн тогтмол NA-д харьцуулсан харьцаагаар тодорхойлогдоно: Нэг молийн массыг ихэвчлэн молийн масс гэнэ M Моляр масс нь тухайн бодисын нэг молекулын m 0 массын Авогадрогийн тогтмолоор үржүүлсэнтэй тэнцүү байна: M \u003d NA м 0 молийн массыг нэг мэнгэ тутамд килограммаар илэрхийлнэ (кг / моль). Молекулууд нь нэг атомаас бүрдэх бодисын хувьд атомын масс гэсэн нэр томъёог ихэвчлэн ашигладаг. Атом ба молекулын нэгж массын хувьд 12 С нүүрстөрөгчийн изотопын атомын массын 1/12 хэсгийг авна (массын дугаар 12-тай). Энэ нэгжийг атомын массын нэгж (аму) гэж нэрлэдэг: 1 a. д. м. \u003d 1.66 · 10-27 кг. Энэ утга нь протон эсвэл нейтроны масстай бараг давхцдаг. Тухайн бодисын атом эсвэл молекулын массын нүүрстөрөгчийн атомын 12 С-ийн массын 1/12 харьцааг харьцангуй масс гэнэ.
Молекул кинетик онол a бодисын хэмжээ нь бодисын N ширхэг тоосонцор (молекул) -ыг Авогадрогийн тогтмол NA-д харьцуулсан харьцаагаар тодорхойлогдоно: Нэг молийн массыг ихэвчлэн молийн масс гэнэ M Моляр масс нь тухайн бодисын нэг молекулын m 0 массын Авогадрогийн тогтмолоор үржүүлсэнтэй тэнцүү байна: M \u003d NA м 0 молийн массыг нэг мэнгэ тутамд килограммаар илэрхийлнэ (кг / моль). Молекулууд нь нэг атомаас бүрдэх бодисын хувьд атомын масс гэсэн нэр томъёог ихэвчлэн ашигладаг. Атом ба молекулын нэгж массын хувьд 12 С нүүрстөрөгчийн изотопын атомын массын 1/12 хэсгийг авна (массын дугаар 12-тай). Энэ нэгжийг атомын массын нэгж (аму) гэж нэрлэдэг: 1 a. д. м. \u003d 1.66 · 10-27 кг. Энэ утга нь протон эсвэл нейтроны масстай бараг давхцдаг. Тухайн бодисын атом эсвэл молекулын массын нүүрстөрөгчийн атомын 12 С-ийн массын 1/12 харьцааг харьцангуй масс гэнэ. Молекул кинетик онол Молекул кинетикийн онолд авч үзсэн хамгийн энгийн загвар бол хамгийн тохиромжтой хийн загвар юм: 1. Кинетик идеал хийн загварт молекулууд 1. хоорондоо болон ханануудтай харилцан уялдаатай, уян хатан мөргөлдөх үед хамгийн тохиромжтой уян хатан бөмбөлөг гэж үздэг. 2. Бүх молекулуудын нийт эзэлхүүнийг 2. хийн байрлаж буй савны эзэлхүүнтэй харьцуулахад бага гэж үзнэ. Хамгийн тохиромжтой хийн загвар нь олон төрлийн даралт, температур дахь бодит хийн зан үйлийг маш сайн дүрсэлсэн байдаг. Молекул кинетик онолын даалгавар бол микроскоп (масс, микроскопийн хурд, молекулуудын кинетик энерги) ба макроскопийн параметрүүд (даралт, эзэлхүүн, макроскопийн параметрүүд, температур) хоорондын хамаарлыг тогтоох явдал юм.
Молекул кинетик онол Молекул кинетикийн онолд авч үзсэн хамгийн энгийн загвар бол хамгийн тохиромжтой хийн загвар юм: 1. Кинетик идеал хийн загварт молекулууд 1. хоорондоо болон ханануудтай харилцан уялдаатай, уян хатан мөргөлдөх үед хамгийн тохиромжтой уян хатан бөмбөлөг гэж үздэг. 2. Бүх молекулуудын нийт эзэлхүүнийг 2. хийн байрлаж буй савны эзэлхүүнтэй харьцуулахад бага гэж үзнэ. Хамгийн тохиромжтой хийн загвар нь олон төрлийн даралт, температур дахь бодит хийн зан үйлийг маш сайн дүрсэлсэн байдаг. Молекул кинетик онолын даалгавар бол микроскоп (масс, микроскопийн хурд, молекулуудын кинетик энерги) ба макроскопийн параметрүүд (даралт, эзэлхүүн, макроскопийн параметрүүд, температур) хоорондын хамаарлыг тогтоох явдал юм. Молекул кинетик онол Молекулууд ба ханануудтай молекулуудын хоорондох мөргөлдөөн бүрийн үр дүнд молекулуудын хурд нь хэмжээ болон чиглэлд өөрчлөгдөж болно; дараалсан мөргөлдөөний хоорондох хугацааны интервал дээр молекулууд жигд, шулуун шугамаар хөдөлдөг. Тохиромжтой хийн загварт бүх мөргөлдөөнүүд уян хатан нөлөөллийн хуулиудын дагуу явагддаг гэж үздэг, өөрөөр хэлбэл Ньютоны механикийн хуулиудыг дагаж мөрддөг. Хамгийн тохиромжтой хийн загварыг ашиглан бид савны ханан дээрх хийн даралтыг тооцдог. Молекулын судасны ханатай харилцан үйлчлэлцэх явцад Ньютоны гуравдахь хуулийг дагаж мөрдөх хүчнүүд хоорондоо үүсдэг. Үүний үр дүнд молекулын хананд перпендикуляр хурдны υx проекц нь түүний тэмдгийг эсрэгээр нь өөрчилж, хананд параллель хурдны υy проекц нь өөрчлөгдөөгүй хэвээр байна (Зураг).
Молекул кинетик онол Молекулууд ба ханануудтай молекулуудын хоорондох мөргөлдөөн бүрийн үр дүнд молекулуудын хурд нь хэмжээ болон чиглэлд өөрчлөгдөж болно; дараалсан мөргөлдөөний хоорондох хугацааны интервал дээр молекулууд жигд, шулуун шугамаар хөдөлдөг. Тохиромжтой хийн загварт бүх мөргөлдөөнүүд уян хатан нөлөөллийн хуулиудын дагуу явагддаг гэж үздэг, өөрөөр хэлбэл Ньютоны механикийн хуулиудыг дагаж мөрддөг. Хамгийн тохиромжтой хийн загварыг ашиглан бид савны ханан дээрх хийн даралтыг тооцдог. Молекулын судасны ханатай харилцан үйлчлэлцэх явцад Ньютоны гуравдахь хуулийг дагаж мөрдөх хүчнүүд хоорондоо үүсдэг. Үүний үр дүнд молекулын хананд перпендикуляр хурдны υx проекц нь түүний тэмдгийг эсрэгээр нь өөрчилж, хананд параллель хурдны υy проекц нь өөрчлөгдөөгүй хэвээр байна (Зураг). Молекул кинетик онол Савны ханан дахь хийн даралтын дундаж томъёог энэ хэлбэрээр бичнэ.Энэ тэгшитгэл нь хамгийн тохиромжтой хийн даралт p, молекулын масс m 0, молекулын концентрац n, хурдны квадратын дундаж утга ба молекулын шилжилт хөдөлгөөний дундаж кинетик энерги хоорондын хамаарлыг тогтоодог. Энэ бол хийн молекул-кинетикийн онолын үндсэн тэгшитгэл юм.Тиймээс хийн даралт нь нэгж эзэлхүүн дотор агуулагдах молекулуудын орчуулах хөдөлгөөний дундаж кинетик энергийн гуравны хоёртой тэнцүү байна.
Молекул кинетик онол Савны ханан дахь хийн даралтын дундаж томъёог энэ хэлбэрээр бичнэ.Энэ тэгшитгэл нь хамгийн тохиромжтой хийн даралт p, молекулын масс m 0, молекулын концентрац n, хурдны квадратын дундаж утга ба молекулын шилжилт хөдөлгөөний дундаж кинетик энерги хоорондын хамаарлыг тогтоодог. Энэ бол хийн молекул-кинетикийн онолын үндсэн тэгшитгэл юм.Тиймээс хийн даралт нь нэгж эзэлхүүн дотор агуулагдах молекулуудын орчуулах хөдөлгөөний дундаж кинетик энергийн гуравны хоёртой тэнцүү байна. Молекул кинетик онол Хийн MKT-ийн үндсэн тэгшитгэлд молекулуудын концентрацийн үржүүлгийн хөдөлгөөний дундаж кинетик энерги орно. Энэ тохиолдолд даралт нь дундаж кинетик энергитэй пропорциональ байна. Дараахь асуултууд гарч байна: тогтмол эзэлхүүнтэй саванд байгаа молекулуудын хөдөлгөөний дундаж кинетик энергийг туршилтаар хэрхэн өөрчилж болох вэ? Кинетикийн дундаж энергийг өөрчлөхийн тулд ямар физик хэмжигдэхүүнийг өөрчлөх шаардлагатай вэ? Туршлагаас харахад температур нь ийм хэмжигдэхүүн юм.
Молекул кинетик онол Хийн MKT-ийн үндсэн тэгшитгэлд молекулуудын концентрацийн үржүүлгийн хөдөлгөөний дундаж кинетик энерги орно. Энэ тохиолдолд даралт нь дундаж кинетик энергитэй пропорциональ байна. Дараахь асуултууд гарч байна: тогтмол эзэлхүүнтэй саванд байгаа молекулуудын хөдөлгөөний дундаж кинетик энергийг туршилтаар хэрхэн өөрчилж болох вэ? Кинетикийн дундаж энергийг өөрчлөхийн тулд ямар физик хэмжигдэхүүнийг өөрчлөх шаардлагатай вэ? Туршлагаас харахад температур нь ийм хэмжигдэхүүн юм. Молекул кинетик онол Температур Температурын тухай ойлголт нь дулааны тэнцвэрийн үзэл баримтлалтай нягт холбоотой байдаг. Бие биетэйгээ шүргэлцсэн биетүүд энерги солилцох боломжтой. Дулаан холбоо барих үед нэг биетээс нөгөө биед шилжих энергийг дулааны хэмжээ Q гэж нэрлэдэг.Дулааны тэнцвэрт байдал гэдэг нь нэг контакт биетээс нөгөө биет рүү дулаан дамжуулалт хийгдээгүй, биеийн бүх макроскоп параметрүүд өөрчлөгдөөгүй, дулааны холбоо барих биетүүдийн системийн төлөв байдлыг хэлнэ. Температур гэдэг нь дулааны тэнцвэрт байдалд байгаа бүх биеийн температуртай ижил физик параметр юм. Температурын тухай ойлголтыг нэвтрүүлэх боломж нь туршлагаас үүдэлтэй бөгөөд термодинамикийн тэг хууль гэж нэрлэдэг.
Молекул кинетик онол Температур Температурын тухай ойлголт нь дулааны тэнцвэрийн үзэл баримтлалтай нягт холбоотой байдаг. Бие биетэйгээ шүргэлцсэн биетүүд энерги солилцох боломжтой. Дулаан холбоо барих үед нэг биетээс нөгөө биед шилжих энергийг дулааны хэмжээ Q гэж нэрлэдэг.Дулааны тэнцвэрт байдал гэдэг нь нэг контакт биетээс нөгөө биет рүү дулаан дамжуулалт хийгдээгүй, биеийн бүх макроскоп параметрүүд өөрчлөгдөөгүй, дулааны холбоо барих биетүүдийн системийн төлөв байдлыг хэлнэ. Температур гэдэг нь дулааны тэнцвэрт байдалд байгаа бүх биеийн температуртай ижил физик параметр юм. Температурын тухай ойлголтыг нэвтрүүлэх боломж нь туршлагаас үүдэлтэй бөгөөд термодинамикийн тэг хууль гэж нэрлэдэг. Молекул-кинетикийн онол Температур Температурыг хэмжихийн тулд температурын утгыг зарим физик параметрүүдийн өөрчлөлтөөр үнэлдэг термометрийг ашигладаг. Термометрийг бий болгохын тулд термометрийн бодис (жишээлбэл, мөнгөн ус, спирт) ба тухайн бодисын шинж чанарыг тодорхойлдог термометрийн утгыг (жишээлбэл, мөнгөн ус эсвэл спиртийн баганын урт) сонгох шаардлагатай. Термометрийн янз бүрийн загварт бодисын янз бүрийн физик шинж чанарыг ашигладаг (жишээлбэл, хатуу биетийн шугаман хэмжээсийн өөрчлөлт эсвэл халах үед дамжуулагчийн цахилгаан эсэргүүцлийн өөрчлөлт). Термометрийг тохируулсан байх ёстой.
Молекул-кинетикийн онол Температур Температурыг хэмжихийн тулд температурын утгыг зарим физик параметрүүдийн өөрчлөлтөөр үнэлдэг термометрийг ашигладаг. Термометрийг бий болгохын тулд термометрийн бодис (жишээлбэл, мөнгөн ус, спирт) ба тухайн бодисын шинж чанарыг тодорхойлдог термометрийн утгыг (жишээлбэл, мөнгөн ус эсвэл спиртийн баганын урт) сонгох шаардлагатай. Термометрийн янз бүрийн загварт бодисын янз бүрийн физик шинж чанарыг ашигладаг (жишээлбэл, хатуу биетийн шугаман хэмжээсийн өөрчлөлт эсвэл халах үед дамжуулагчийн цахилгаан эсэргүүцлийн өөрчлөлт). Термометрийг тохируулсан байх ёстой. Молекул-кинетик онол Физикт онцгой байр эзэлдэг хийн термометр (Зураг), үүнд термометрийн бодис нь тогтмол эзэлхүүнтэй (V \u003d const) саванд байдаг ховордсон хий (гелий, агаар) бөгөөд термометрийн утга нь хийн даралт p юм. Туршлагаас харахад хийн даралтыг (V \u003d const-д) Цельсийн хэмжээсээр хэмжсэн температур нэмэгдэхэд нэмэгддэг.
Молекул-кинетик онол Физикт онцгой байр эзэлдэг хийн термометр (Зураг), үүнд термометрийн бодис нь тогтмол эзэлхүүнтэй (V \u003d const) саванд байдаг ховордсон хий (гелий, агаар) бөгөөд термометрийн утга нь хийн даралт p юм. Туршлагаас харахад хийн даралтыг (V \u003d const-д) Цельсийн хэмжээсээр хэмжсэн температур нэмэгдэхэд нэмэгддэг. Молекул кинетик онол Тогтмол эзэлхүүнтэй хийн термометрийг тохируулахын тулд даралтыг хоёр температурт хэмжиж болно (жишээлбэл, 0 ° C ба 100 ° C), график дээр p 0 ба p 100 цэгүүдийг зурж, дараа нь тэдгээрийн хооронд шулуун шугам зурна (Зураг 6 ). Үүссэн калибровкын графикийг ашиглан бусад даралттай тохирох температурыг тодорхойлж болно. Графикийг нам даралтын бүсэд экстраполяц хийснээр нам даралтын графикийг экстраполяцаар хийснээр хийн даралт тэг болох зарим "таамаглалын" температурыг тодорхойлж болно. Туршлагаас харахад энэ температур нь 273, 15 ° C бөгөөд хийн шинж чанараас хамаардаггүй. Туршилтаар тэг даралттай төлөвт хөргөх замаар хий авах боломжгүй, учир нь маш бага температурт бүх хий шингэн эсвэл хатуу төлөвт ордог.
Молекул кинетик онол Тогтмол эзэлхүүнтэй хийн термометрийг тохируулахын тулд даралтыг хоёр температурт хэмжиж болно (жишээлбэл, 0 ° C ба 100 ° C), график дээр p 0 ба p 100 цэгүүдийг зурж, дараа нь тэдгээрийн хооронд шулуун шугам зурна (Зураг 6 ). Үүссэн калибровкын графикийг ашиглан бусад даралттай тохирох температурыг тодорхойлж болно. Графикийг нам даралтын бүсэд экстраполяц хийснээр нам даралтын графикийг экстраполяцаар хийснээр хийн даралт тэг болох зарим "таамаглалын" температурыг тодорхойлж болно. Туршлагаас харахад энэ температур нь 273, 15 ° C бөгөөд хийн шинж чанараас хамаардаггүй. Туршилтаар тэг даралттай төлөвт хөргөх замаар хий авах боломжгүй, учир нь маш бага температурт бүх хий шингэн эсвэл хатуу төлөвт ордог. Молекул-кинетикийн онол Английн физикч В.Келвин (Томсон) 1848 онд хийн даралтын тэг цэгийг ашиглан температурын шинэ хуваарийг (Келвины хуваарь) бий болгохыг санал болгов. Энэ хуваарьт температур хэмжих нэгж нь Цельсийн хэмжигдэхүүнтэй ижил боловч тэг цэгийг шилжүүлсэн болно: TK \u003d TC + 273, 15. SI системд Келвин хэмжих нэгжийг Келвин хэмжүүрээр нэрлээд K үсгийг тэмдэглэх нь зүйтэй. \u003d Кельвины хуваарийн дагуу 20 ° C нь TK \u003d 293, 15 K-тай тэнцүү байна.
Молекул-кинетикийн онол Английн физикч В.Келвин (Томсон) 1848 онд хийн даралтын тэг цэгийг ашиглан температурын шинэ хуваарийг (Келвины хуваарь) бий болгохыг санал болгов. Энэ хуваарьт температур хэмжих нэгж нь Цельсийн хэмжигдэхүүнтэй ижил боловч тэг цэгийг шилжүүлсэн болно: TK \u003d TC + 273, 15. SI системд Келвин хэмжих нэгжийг Келвин хэмжүүрээр нэрлээд K үсгийг тэмдэглэх нь зүйтэй. \u003d Кельвины хуваарийн дагуу 20 ° C нь TK \u003d 293, 15 K-тай тэнцүү байна. Молекул кинетик онол Кельвины температурын хуваарийг абсолют температурын хэмжүүр гэж нэрлэдэг. Энэ нь физик онолыг байгуулахад хамгийн тохиромжтой температурын хуваарь болж хувирав. Кельвины хуваарийг тогтсон хоёр цэг дээр - Цельсийн хэмжүүр дээр тогтсон заншил ёсоор мөс хайлах цэг ба усны буцлах температурыг хэвийн атмосферийн даралттай холбох шаардлагагүй. Үнэмлэхүй тэг температур гэж нэрлэдэг тэг хийн даралтын цэгээс гадна өөр нэг тогтмол лавлах цэгийг үнэмлэхүй тэг гэж хүлээн авахад хангалттай. Кельвины хуваарьт усны гурвалсан цэгийн температурыг (0.01 ° C) ийм цэг болгон ашигладаг бөгөөд энэ гурван үе шат нь дулааны тэнцвэрт байдал - мөс, ус, уур юм. Кельвины хуваарийн дагуу гурвалсан цэгийн температурыг 273.16 К гэж авна.
Молекул кинетик онол Кельвины температурын хуваарийг абсолют температурын хэмжүүр гэж нэрлэдэг. Энэ нь физик онолыг байгуулахад хамгийн тохиромжтой температурын хуваарь болж хувирав. Кельвины хуваарийг тогтсон хоёр цэг дээр - Цельсийн хэмжүүр дээр тогтсон заншил ёсоор мөс хайлах цэг ба усны буцлах температурыг хэвийн атмосферийн даралттай холбох шаардлагагүй. Үнэмлэхүй тэг температур гэж нэрлэдэг тэг хийн даралтын цэгээс гадна өөр нэг тогтмол лавлах цэгийг үнэмлэхүй тэг гэж хүлээн авахад хангалттай. Кельвины хуваарьт усны гурвалсан цэгийн температурыг (0.01 ° C) ийм цэг болгон ашигладаг бөгөөд энэ гурван үе шат нь дулааны тэнцвэрт байдал - мөс, ус, уур юм. Кельвины хуваарийн дагуу гурвалсан цэгийн температурыг 273.16 К гэж авна. Молекул-кинетикийн онол Тиймээс V тогтмол эзэлхүүнтэй саванд ховордсон хийн даралт нь түүний үнэмлэхүй температуртай шууд пропорциональ байдлаар өөрчлөгддөг: p ~ T. Нөгөөтэйгүүр, туршлага V нь тогтмол эзэлхүүн ба T температурын үед хийн даралт нь бодисын хэмжээтэй шууд пропорциональ байдлаар өөрчлөгддөг болохыг харуулж байна. ν өгөгдсөн саванд савны V эзэлхүүн, N нь сав дахь молекулын тоо, NA нь Авогадрогийн тогтмол, n \u003d N / V нь молекулын концентраци (өөрөөр хэлбэл савны нэгж эзэлхүүн дэх молекулын тоо).
Молекул-кинетикийн онол Тиймээс V тогтмол эзэлхүүнтэй саванд ховордсон хийн даралт нь түүний үнэмлэхүй температуртай шууд пропорциональ байдлаар өөрчлөгддөг: p ~ T. Нөгөөтэйгүүр, туршлага V нь тогтмол эзэлхүүн ба T температурын үед хийн даралт нь бодисын хэмжээтэй шууд пропорциональ байдлаар өөрчлөгддөг болохыг харуулж байна. ν өгөгдсөн саванд савны V эзэлхүүн, N нь сав дахь молекулын тоо, NA нь Авогадрогийн тогтмол, n \u003d N / V нь молекулын концентраци (өөрөөр хэлбэл савны нэгж эзэлхүүн дэх молекулын тоо). Молекул кинетик онол Эдгээр пропорциональ хамаарлыг нэгтгэн бид дараахь зүйлийг бичиж болно: p \u003d nk. T, энд k нь бүх хийд тогтмол, түгээмэл байдаг. MKT-ийг үндэслэгчдийн нэг Австрийн физикч Л.Больцманы нэрээр үүнийг Больцманы тогтмол гэж нэрлэдэг. Больцманы тогтмол нь физикийн үндсэн тогтмолуудын нэг юм. Түүний SI дэх тоон утга: k \u003d 1, 38 · 10–23 J / K.
Молекул кинетик онол Эдгээр пропорциональ хамаарлыг нэгтгэн бид дараахь зүйлийг бичиж болно: p \u003d nk. T, энд k нь бүх хийд тогтмол, түгээмэл байдаг. MKT-ийг үндэслэгчдийн нэг Австрийн физикч Л.Больцманы нэрээр үүнийг Больцманы тогтмол гэж нэрлэдэг. Больцманы тогтмол нь физикийн үндсэн тогтмолуудын нэг юм. Түүний SI дэх тоон утга: k \u003d 1, 38 · 10–23 J / K. Молекул кинетик онол p \u003d nk харьцааг харьцуулах. MKT хийн үндсэн тэгшитгэлтэйгээр та дараахь зүйлийг авч болно: Хийн молекулуудын эмх замбараагүй хөдөлгөөний дундаж кинетик энерги нь үнэмлэхүй температуртай шууд пропорциональ байна. Тиймээс температур нь молекулуудын шилжих хөдөлгөөний дундаж кинетик энергийн хэмжүүр юм.Молекулын орчуулах хөдөлгөөний дундаж кинетик энерги нь түүний массаас хамаардаггүй болохыг тэмдэглэх нь зүйтэй. Шингэн эсвэл хийнд түдгэлзсэн броуны бөөмс нь бие даасан молекулын дундаж кинетик энергитэй ижил бөгөөд масс нь броун бөөмийн массаас олон эрэмбээр бага байдаг.
Молекул кинетик онол p \u003d nk харьцааг харьцуулах. MKT хийн үндсэн тэгшитгэлтэйгээр та дараахь зүйлийг авч болно: Хийн молекулуудын эмх замбараагүй хөдөлгөөний дундаж кинетик энерги нь үнэмлэхүй температуртай шууд пропорциональ байна. Тиймээс температур нь молекулуудын шилжих хөдөлгөөний дундаж кинетик энергийн хэмжүүр юм.Молекулын орчуулах хөдөлгөөний дундаж кинетик энерги нь түүний массаас хамаардаггүй болохыг тэмдэглэх нь зүйтэй. Шингэн эсвэл хийнд түдгэлзсэн броуны бөөмс нь бие даасан молекулын дундаж кинетик энергитэй ижил бөгөөд масс нь броун бөөмийн массаас олон эрэмбээр бага байдаг. Молекул-кинетикийн онол Энэ сав нь молекулууд нь өөр өөр масстай химийн харилцан үйлчлэлцдэггүй хийн холимог агуулсан тохиолдолд л хамаарна. Тэнцвэртэй байдалд янз бүрийн хийн молекулууд нь дулааны хөдөлгөөний ижил дундаж кинетик энергитэй байх бөгөөд зөвхөн хольцын температураар тодорхойлно. Савны ханан дээрх хийн хольцын даралт нь хий бүрийн хэсэгчилсэн даралтын нийлбэр болно: p \u003d p 1 + p 2 + p 3 +… \u003d (n 1 + n 2 + n 3 +…) k. T Энэ харьцаагаар n 1, n 2, n 3, ... нь холимог дахь янз бүрийн хийн молекулуудын концентраци юм. Энэхүү харьцаа нь 19-р зууны эхэн үед туршилтаар тогтоосон Далтоны хуулийг молекул кинетик онолын хэлээр илэрхийлдэг: Далтоны химийн харилцан үйлчлэлцдэггүй хийн холимог дахь даралт нь тэдгээрийн хэсэгчилсэн даралтын нийлбэртэй тэнцүү байна.
Молекул-кинетикийн онол Энэ сав нь молекулууд нь өөр өөр масстай химийн харилцан үйлчлэлцдэггүй хийн холимог агуулсан тохиолдолд л хамаарна. Тэнцвэртэй байдалд янз бүрийн хийн молекулууд нь дулааны хөдөлгөөний ижил дундаж кинетик энергитэй байх бөгөөд зөвхөн хольцын температураар тодорхойлно. Савны ханан дээрх хийн хольцын даралт нь хий бүрийн хэсэгчилсэн даралтын нийлбэр болно: p \u003d p 1 + p 2 + p 3 +… \u003d (n 1 + n 2 + n 3 +…) k. T Энэ харьцаагаар n 1, n 2, n 3, ... нь холимог дахь янз бүрийн хийн молекулуудын концентраци юм. Энэхүү харьцаа нь 19-р зууны эхэн үед туршилтаар тогтоосон Далтоны хуулийг молекул кинетик онолын хэлээр илэрхийлдэг: Далтоны химийн харилцан үйлчлэлцдэггүй хийн холимог дахь даралт нь тэдгээрийн хэсэгчилсэн даралтын нийлбэртэй тэнцүү байна. Молекул кинетик онол Идеал хийн төлөвийн тэгшитгэл Харьцааны харьцаа p \u003d nk. T нь хийн макроскоп параметрүүд - V хэмжээ, даралт p, температур T ба бодисын хэмжээ ν \u003d m / M. хоорондын хамаарлыг тогтоодог өөр хэлбэрээр бичиж болно. M –– Энэ хамаарлыг идеал хийн төлөв байдлын тэгшитгэл буюу хамгийн тохиромжтой хийн төлөв байдлын тэгшитгэл гэж нэрлэдэг Клапейрон - Менделеев - Авогадро тогтмол NA-г Больцманы тогтмол k-ийн үржвэрийг бүх нийтийн хийн тогтмол гэж нэрлэдэг ба R үсгээр тэмдэглэв SI дэх тоон утга нь: R \u003d k ∙ NA \u003d 8, 31 J / mol · K
Молекул кинетик онол Идеал хийн төлөвийн тэгшитгэл Харьцааны харьцаа p \u003d nk. T нь хийн макроскоп параметрүүд - V хэмжээ, даралт p, температур T ба бодисын хэмжээ ν \u003d m / M. хоорондын хамаарлыг тогтоодог өөр хэлбэрээр бичиж болно. M –– Энэ хамаарлыг идеал хийн төлөв байдлын тэгшитгэл буюу хамгийн тохиромжтой хийн төлөв байдлын тэгшитгэл гэж нэрлэдэг Клапейрон - Менделеев - Авогадро тогтмол NA-г Больцманы тогтмол k-ийн үржвэрийг бүх нийтийн хийн тогтмол гэж нэрлэдэг ба R үсгээр тэмдэглэв SI дэх тоон утга нь: R \u003d k ∙ NA \u003d 8, 31 J / mol · K Молекул кинетик онол Идеал хийн төлөв байдлын тэгшитгэл - Хэрэв хийн температур Tn \u003d 273.15 K (0 ° C), даралт pn \u003d 1 atm \u003d 1.013105 Па-тай тэнцүү бол хий хэвийн нөхцөлд байна гэж хэлдэг. Идеал хийн төлөвийн тэгшитгэлээс харахад хэвийн нөхцөлд нэг моль ямар ч хий ижил эзэлхүүн эзэлдэг V 0 \u003d 0.0224 м 3 / моль \u003d 22.4 дм 3 / моль. Энэ мэдэгдлийг Авогадрогийн хууль гэж нэрлэдэг.
Молекул кинетик онол Идеал хийн төлөв байдлын тэгшитгэл - Хэрэв хийн температур Tn \u003d 273.15 K (0 ° C), даралт pn \u003d 1 atm \u003d 1.013105 Па-тай тэнцүү бол хий хэвийн нөхцөлд байна гэж хэлдэг. Идеал хийн төлөвийн тэгшитгэлээс харахад хэвийн нөхцөлд нэг моль ямар ч хий ижил эзэлхүүн эзэлдэг V 0 \u003d 0.0224 м 3 / моль \u003d 22.4 дм 3 / моль. Энэ мэдэгдлийг Авогадрогийн хууль гэж нэрлэдэг. Молекул кинетик онол Изопроцессууд Хийн байдал, түүний төлөв байдлыг тодорхойлсон бүх параметрүүд (p, V, T) өөрчлөгдөж болох янз бүрийн дулааны процесст оролцож болно. Хэрэв процесс хангалттай удаан явагдаж байвал ямар ч үед систем тэнцвэрт байдалдаа ойрхон байна. Ийм процессыг бараг статик гэж нэрлэдэг. Бидний хувьд ердийн хагас статик цагийн хуваарьт эдгээр процессууд удаан явагдахгүй байж магадгүй юм. Жишээлбэл, секундэд хэдэн зуун удаа тохиолддог дуу чимээний долгион дахь хий ховордож, шахагддагийг бараг статик процесс гэж үзэж болно. Квазистатик процессуудыг төлөвийн диаграммд (жишээлбэл, p, V координатад) траектор байдлаар дүрсэлж болох бөгөөд цэг бүр нь тэнцвэрт байдлыг илэрхийлнэ. Үзүүлэлтүүдийн нэг нь (p, V эсвэл T) өөрчлөгдөөгүй байх процессууд юм. Ийм процессыг изопроцесс гэж нэрлэдэг.
Молекул кинетик онол Изопроцессууд Хийн байдал, түүний төлөв байдлыг тодорхойлсон бүх параметрүүд (p, V, T) өөрчлөгдөж болох янз бүрийн дулааны процесст оролцож болно. Хэрэв процесс хангалттай удаан явагдаж байвал ямар ч үед систем тэнцвэрт байдалдаа ойрхон байна. Ийм процессыг бараг статик гэж нэрлэдэг. Бидний хувьд ердийн хагас статик цагийн хуваарьт эдгээр процессууд удаан явагдахгүй байж магадгүй юм. Жишээлбэл, секундэд хэдэн зуун удаа тохиолддог дуу чимээний долгион дахь хий ховордож, шахагддагийг бараг статик процесс гэж үзэж болно. Квазистатик процессуудыг төлөвийн диаграммд (жишээлбэл, p, V координатад) траектор байдлаар дүрсэлж болох бөгөөд цэг бүр нь тэнцвэрт байдлыг илэрхийлнэ. Үзүүлэлтүүдийн нэг нь (p, V эсвэл T) өөрчлөгдөөгүй байх процессууд юм. Ийм процессыг изопроцесс гэж нэрлэдэг. Изотермийн процесс (T \u003d const) Изотермийн процесс нь тогтмол температурт Т-д тохиолддог квазатик процесс юм. Идеал хийн төлөв байдлын тэгшитгэлээс харахад Т ба Т тогтмол температурт сав дахь ν бодисын хэмжээ тогтмол байх бөгөөд хийн даралтын үржвэр ба түүний эзэлхүүн V хэвээр байх ёстой. тогтмол: х. V \u003d const
Изотермийн процесс (T \u003d const) Изотермийн процесс нь тогтмол температурт Т-д тохиолддог квазатик процесс юм. Идеал хийн төлөв байдлын тэгшитгэлээс харахад Т ба Т тогтмол температурт сав дахь ν бодисын хэмжээ тогтмол байх бөгөөд хийн даралтын үржвэр ба түүний эзэлхүүн V хэвээр байх ёстой. тогтмол: х. V \u003d const Изотермийн процесс (T \u003d const) (p, V) хавтгайд изотермийн процессыг T температурын янз бүрийн утгуудаар p ~ 1 / V гиперболын гэр бүлээр дүрсэлдэг бөгөөд үүнийг изотерм гэж нэрлэдэг. Изотермийн процессын тэгшитгэлийг Английн физикч Р.Бойль (1662), Францын физикч Э.Мариотте (1676) бие даан туршилтаар олж авсан тул тэгшитгэлийг Бойль - Мариоттын хууль гэж нэрлэдэг. T 3\u003e T 2\u003e T 1
Изотермийн процесс (T \u003d const) (p, V) хавтгайд изотермийн процессыг T температурын янз бүрийн утгуудаар p ~ 1 / V гиперболын гэр бүлээр дүрсэлдэг бөгөөд үүнийг изотерм гэж нэрлэдэг. Изотермийн процессын тэгшитгэлийг Английн физикч Р.Бойль (1662), Францын физикч Э.Мариотте (1676) бие даан туршилтаар олж авсан тул тэгшитгэлийг Бойль - Мариоттын хууль гэж нэрлэдэг. T 3\u003e T 2\u003e T 1 Изохорик процесс (V \u003d const) Изохорик процесс гэдэг нь тогтмол хэмжээтэй V-д хийнийг статик халаалт эсвэл хөргөх үйл явц бөгөөд хэрэв сав дахь ν бодисын хэмжээ өөрчлөгдөөгүй бол. Идеал хийн төлөвийн тэгшитгэлээс харахад эдгээр нөхцөлд хийн даралт p нь түүний үнэмлэхүй температуртай шууд пропорциональ өөрчлөгдөнө: p ~ T эсвэл \u003d const
Изохорик процесс (V \u003d const) Изохорик процесс гэдэг нь тогтмол хэмжээтэй V-д хийнийг статик халаалт эсвэл хөргөх үйл явц бөгөөд хэрэв сав дахь ν бодисын хэмжээ өөрчлөгдөөгүй бол. Идеал хийн төлөвийн тэгшитгэлээс харахад эдгээр нөхцөлд хийн даралт p нь түүний үнэмлэхүй температуртай шууд пропорциональ өөрчлөгдөнө: p ~ T эсвэл \u003d const Изохорийн процесс (V \u003d const) (p, T) хавтгай дээр өгөгдсөн хэмжээний for бодисын эзэлхүүний V өөр өөр утгын изохорик процессыг изохор гэж нэрлэдэг шулуун шугамын гэр бүлээр дүрсэлсэн болно. Эзлэхүүний том утга нь температурын тэнхлэгтэй харьцуулахад бага налуутай изохоруудтай тохирч байна (Зураг). Францын физикч Ж.Чарльз (1787) хийн даралтын температураас хамаарлыг туршилтаар судлав. Тиймээс изохорик процессын тэгшитгэлийг Чарльзын хууль гэж нэрлэдэг. V 3\u003e V 2\u003e V 1
Изохорийн процесс (V \u003d const) (p, T) хавтгай дээр өгөгдсөн хэмжээний for бодисын эзэлхүүний V өөр өөр утгын изохорик процессыг изохор гэж нэрлэдэг шулуун шугамын гэр бүлээр дүрсэлсэн болно. Эзлэхүүний том утга нь температурын тэнхлэгтэй харьцуулахад бага налуутай изохоруудтай тохирч байна (Зураг). Францын физикч Ж.Чарльз (1787) хийн даралтын температураас хамаарлыг туршилтаар судлав. Тиймээс изохорик процессын тэгшитгэлийг Чарльзын хууль гэж нэрлэдэг. V 3\u003e V 2\u003e V 1 Изобарик процесс (p \u003d const) Изобарик процесс гэдэг нь тогтмол p даралтанд явагддаг бараг статик процесс юм. Тодорхой тогтмол хэмжээний for бодисын изобарик процессын тэгшитгэл дараах хэлбэртэй байна: энд V 0 нь 0 ° C температурт хийн эзэлхүүн юм. Α коэффициент нь (1/273, 15) K– -тэй тэнцүү байна. Түүний α-ийг хийн эзэлхүүний тэлэлтийн температурын коэффициент гэж нэрлэдэг.
Изобарик процесс (p \u003d const) Изобарик процесс гэдэг нь тогтмол p даралтанд явагддаг бараг статик процесс юм. Тодорхой тогтмол хэмжээний for бодисын изобарик процессын тэгшитгэл дараах хэлбэртэй байна: энд V 0 нь 0 ° C температурт хийн эзэлхүүн юм. Α коэффициент нь (1/273, 15) K– -тэй тэнцүү байна. Түүний α-ийг хийн эзэлхүүний тэлэлтийн температурын коэффициент гэж нэрлэдэг. Изобарик процесс (p \u003d const) (V, T) хавтгай дээр p даралтын өөр өөр утгын изобарийн процессыг шулуун шугамын гэр бүлээр дүрсэлсэн байдаг (Зураг). Тогтмол даралттай үед хийн эзэлхүүн температураас хамаарах хамаарлыг Францын физикч Ж.Гей-Люссак (1862) туршилтаар судлав. Тиймээс изобарийн процессын тэгшитгэлийг Гей-Люссакийн хууль гэж нэрлэдэг. p 3\u003e p 2\u003e p 1
Изобарик процесс (p \u003d const) (V, T) хавтгай дээр p даралтын өөр өөр утгын изобарийн процессыг шулуун шугамын гэр бүлээр дүрсэлсэн байдаг (Зураг). Тогтмол даралттай үед хийн эзэлхүүн температураас хамаарах хамаарлыг Францын физикч Ж.Гей-Люссак (1862) туршилтаар судлав. Тиймээс изобарийн процессын тэгшитгэлийг Гей-Люссакийн хууль гэж нэрлэдэг. p 3\u003e p 2\u003e p 1 Изопроцессууд Бойль-Мариотт, Чарльз, Гей-Луссак нарын туршилтаар тогтоосон хуулиуд - Мариотт, Чарльз, Гей-Люссак нарын хийнүүдийн молекул-кинетикийн онолд өгсөн тайлбар. Эдгээр нь төлөвийн хамгийн тохиромжтой хийн тэгшитгэлийн үр дагавар юм.
Изопроцессууд Бойль-Мариотт, Чарльз, Гей-Луссак нарын туршилтаар тогтоосон хуулиуд - Мариотт, Чарльз, Гей-Люссак нарын хийнүүдийн молекул-кинетикийн онолд өгсөн тайлбар. Эдгээр нь төлөвийн хамгийн тохиромжтой хийн тэгшитгэлийн үр дагавар юм. Термодинамик Термодинамик бол дулааны үзэгдлийн тухай шинжлэх ухаан юм. Бодисын молекулын бүтцийн талаархи санаан дээр үндэслэн дүгнэлт хийдэг молекул кинетик онолоос ялгаатай нь термодинамик нь дулааны процессын хамгийн ерөнхий хууль, макроскопийн системийн шинж чанаруудаас үүдэлтэй юм. Термодинамикийн дүгнэлт нь туршилтын багц баримт дээр үндэслэсэн бөгөөд бидний материйн дотоод бүтцийн талаархи мэдлэгээс хамаардаггүй боловч хэд хэдэн тохиолдолд термодинамик нь дүгнэлтээ харуулахын тулд молекул кинетик загварыг ашигладаг.
Термодинамик Термодинамик бол дулааны үзэгдлийн тухай шинжлэх ухаан юм. Бодисын молекулын бүтцийн талаархи санаан дээр үндэслэн дүгнэлт хийдэг молекул кинетик онолоос ялгаатай нь термодинамик нь дулааны процессын хамгийн ерөнхий хууль, макроскопийн системийн шинж чанаруудаас үүдэлтэй юм. Термодинамикийн дүгнэлт нь туршилтын багц баримт дээр үндэслэсэн бөгөөд бидний материйн дотоод бүтцийн талаархи мэдлэгээс хамаардаггүй боловч хэд хэдэн тохиолдолд термодинамик нь дүгнэлтээ харуулахын тулд молекул кинетик загварыг ашигладаг. Термодинамик Термодинамик гэж үздэг тусгаарлагдсан системүүд термодинамикийн тэнцвэрт байдалд байгаа биетүүд. Энэ нь ажиглагдах бүх макроскопийн процессууд ийм системд зогссон гэсэн үг юм.
Термодинамик Термодинамик гэж үздэг тусгаарлагдсан системүүд термодинамикийн тэнцвэрт байдалд байгаа биетүүд. Энэ нь ажиглагдах бүх макроскопийн процессууд ийм системд зогссон гэсэн үг юм. Термодинамик Хэрэв термодинамикийн систем гадны нөлөөнд автсан бол эцэст нь өөр тэнцвэрт байдалд шилжих болно. Энэ шилжилтийг термодинамик процесс гэж нэрлэдэг. Хэрэв процесс хангалттай удаан явагдаж байвал (хязгаар дотор, хязгааргүй удаан) цаг хугацааны агшин тутамд систем тэнцвэрт байдалд ойрхон болж хувирна. Тэнцвэрийн төлөв байдлын дараалалаас бүрдэх процессыг квазататик гэж нэрлэдэг.
Термодинамик Хэрэв термодинамикийн систем гадны нөлөөнд автсан бол эцэст нь өөр тэнцвэрт байдалд шилжих болно. Энэ шилжилтийг термодинамик процесс гэж нэрлэдэг. Хэрэв процесс хангалттай удаан явагдаж байвал (хязгаар дотор, хязгааргүй удаан) цаг хугацааны агшин тутамд систем тэнцвэрт байдалд ойрхон болж хувирна. Тэнцвэрийн төлөв байдлын дараалалаас бүрдэх процессыг квазататик гэж нэрлэдэг. Термодинамик. Дотоод энерги Термодинамикийн хамгийн чухал ойлголтуудын нэг бол биеийн дотоод энерги юм. Бүх макроскопийн биетүүд бие махбодид агуулагдах энерги байдаг. MCT-ийн үүднээс бодисын дотоод энерги нь бүх атом, молекулуудын кинетик энерги ба тэдгээрийн харилцан үйлчлэлийн боломжит энергиэс бүрдэнэ. Ялангуяа идеал хийн дотоод энерги нь тасралтгүй ба санамсаргүй дулааны хөдөлгөөн дэх бүх хийн хэсгүүдийн кинетик энергийн нийлбэртэй тэнцүү байна. Энэ нь олон тооны туршилтаар батлагдсан Жоулын хуулийг илэрхийлж байна: Төгс хийн дотоод энерги нь зөвхөн түүний температураас хамаардаг ба эзэлхүүнээс хамаардаггүй.
Термодинамик. Дотоод энерги Термодинамикийн хамгийн чухал ойлголтуудын нэг бол биеийн дотоод энерги юм. Бүх макроскопийн биетүүд бие махбодид агуулагдах энерги байдаг. MCT-ийн үүднээс бодисын дотоод энерги нь бүх атом, молекулуудын кинетик энерги ба тэдгээрийн харилцан үйлчлэлийн боломжит энергиэс бүрдэнэ. Ялангуяа идеал хийн дотоод энерги нь тасралтгүй ба санамсаргүй дулааны хөдөлгөөн дэх бүх хийн хэсгүүдийн кинетик энергийн нийлбэртэй тэнцүү байна. Энэ нь олон тооны туршилтаар батлагдсан Жоулын хуулийг илэрхийлж байна: Төгс хийн дотоод энерги нь зөвхөн түүний температураас хамаардаг ба эзэлхүүнээс хамаардаггүй. Термодинамик. MCT-ийн дотоод энерги нь молекулууд нь зөвхөн орчуулгын хөдөлгөөн хийдэг идеал монатомын хий (гелий, неон гэх мэт) -ийн нэг молийн дотоод энергийг дараахь илэрхийлэлд хүргэдэг: Молекулуудын харилцан үйлчлэлийн боломжит энерги нь тэдгээрийн хоорондын зайнаас хамаардаг тул ерөнхийдөө биеийн дотоод энерги U температурын хамт T бас V эзэлхүүн дээр: TU \u003d U (T, V) Тиймээс биеийн дотоод энерги U нь биеийн төлөв байдлыг тодорхойлдог макроскоп параметрүүдээр тодорхойлогдоно. Энэ байдал хэрхэн хэрэгжсэнээс шалтгаалахгүй. Дотоод энерги нь төрийн үйл ажиллагаа гэж хэлдэг заншилтай.
Термодинамик. MCT-ийн дотоод энерги нь молекулууд нь зөвхөн орчуулгын хөдөлгөөн хийдэг идеал монатомын хий (гелий, неон гэх мэт) -ийн нэг молийн дотоод энергийг дараахь илэрхийлэлд хүргэдэг: Молекулуудын харилцан үйлчлэлийн боломжит энерги нь тэдгээрийн хоорондын зайнаас хамаардаг тул ерөнхийдөө биеийн дотоод энерги U температурын хамт T бас V эзэлхүүн дээр: TU \u003d U (T, V) Тиймээс биеийн дотоод энерги U нь биеийн төлөв байдлыг тодорхойлдог макроскоп параметрүүдээр тодорхойлогдоно. Энэ байдал хэрхэн хэрэгжсэнээс шалтгаалахгүй. Дотоод энерги нь төрийн үйл ажиллагаа гэж хэлдэг заншилтай. Термодинамик. Дотоод энергийг өөрчлөх арга Биеийн дотоод энерги нь түүнд нөлөөлж буй гадны хүчин зүйлүүд (эерэг эсвэл сөрөг) ажиллавал өөрчлөгдөж болно. ажил Жишээлбэл, хэрэв хий нь поршений доор байрлах цилиндрт шахагдсан бол гадны хүч A хий дээр зарим эерэг ажил гүйцэтгэдэг. Үүний зэрэгцээ хийн "поршений дээр ажиллаж байгаа А даралтын хүч A \u003d –A" ажлыг гүйцэтгэдэг.
Термодинамик. Дотоод энергийг өөрчлөх арга Биеийн дотоод энерги нь түүнд нөлөөлж буй гадны хүчин зүйлүүд (эерэг эсвэл сөрөг) ажиллавал өөрчлөгдөж болно. ажил Жишээлбэл, хэрэв хий нь поршений доор байрлах цилиндрт шахагдсан бол гадны хүч A хий дээр зарим эерэг ажил гүйцэтгэдэг. Үүний зэрэгцээ хийн "поршений дээр ажиллаж байгаа А даралтын хүч A \u003d –A" ажлыг гүйцэтгэдэг. Термодинамик. Дотоод энергийг өөрчлөх арга Биеийн дотоод энерги нь зөвхөн гүйцэтгэсэн ажлын үр дүнд төдийгүй дулааны солилцооны үр дүнд өөрчлөгдөж болно. Биеийн дулааны холбоо барих үед тэдгээрийн нэгний дотоод энерги нэмэгдэж, нөгөө нь буурч болно. Энэ тохиолдолд тэд нэг биеэс нөгөөд шилжих дулааны урсгалыг ярьдаг. Бие махбодид хүлээн авсан Q дулааны хэмжээ, Q дулааны хэмжээг дулааны солилцооны үр дүнд биеийн дотоод энергийн өөрчлөлт гэж нэрлэдэг.
Термодинамик. Дотоод энергийг өөрчлөх арга Биеийн дотоод энерги нь зөвхөн гүйцэтгэсэн ажлын үр дүнд төдийгүй дулааны солилцооны үр дүнд өөрчлөгдөж болно. Биеийн дулааны холбоо барих үед тэдгээрийн нэгний дотоод энерги нэмэгдэж, нөгөө нь буурч болно. Энэ тохиолдолд тэд нэг биеэс нөгөөд шилжих дулааны урсгалыг ярьдаг. Бие махбодид хүлээн авсан Q дулааны хэмжээ, Q дулааны хэмжээг дулааны солилцооны үр дүнд биеийн дотоод энергийн өөрчлөлт гэж нэрлэдэг. Термодинамик. Дотоод энергийг өөрчлөх арга Эрчим хүчийг нэг биеэс нөгөө биед дулаан хэлбэрээр шилжүүлэх нь тэдгээрийн хоорондох температурын зөрүүтэй үед л тохиолдож болно. Дулааны урсгал нь үргэлж халуун биетээс хүйтэн рүү чиглүүлдэг.Дулааны Q хэмжээ нь энергийн хэмжигдэхүүн юм. SI-д дулааны хэмжээг механик ажлын нэгжээр хэмждэг - joules (J).
Термодинамик. Дотоод энергийг өөрчлөх арга Эрчим хүчийг нэг биеэс нөгөө биед дулаан хэлбэрээр шилжүүлэх нь тэдгээрийн хоорондох температурын зөрүүтэй үед л тохиолдож болно. Дулааны урсгал нь үргэлж халуун биетээс хүйтэн рүү чиглүүлдэг.Дулааны Q хэмжээ нь энергийн хэмжигдэхүүн юм. SI-д дулааны хэмжээг механик ажлын нэгжээр хэмждэг - joules (J). Термодинамик. Термодинамикийн анхны хууль Сонгосон термодинамикийн систем ба хүрээлэн буй биетүүдийн хоорондох энергийн урсгалыг уламжлалт байдлаар харуулав. Хэрэв дулааны Q\u003e 0 урсгал нь термодинамикийн систем рүү чиглэсэн бол Q\u003e 0 утга. Хэрэв систем хүрээлэн буй биетүүд дээр эерэг ажил хийвэл A\u003e 0 утга. Хэрэв систем нь хүрээлэн буй биетүүдтэйгээ дулааны солилцоо хийж, (эерэг эсвэл сөрөг) ажил гүйцэтгэдэг бол системийн төлөв өөрчлөгдөж, системийн байдал өөрчлөгдөж, өөрөөр хэлбэл түүний макроскоп параметрүүд (температур, даралт, эзэлхүүн) өөрчлөгддөг.
Термодинамик. Термодинамикийн анхны хууль Сонгосон термодинамикийн систем ба хүрээлэн буй биетүүдийн хоорондох энергийн урсгалыг уламжлалт байдлаар харуулав. Хэрэв дулааны Q\u003e 0 урсгал нь термодинамикийн систем рүү чиглэсэн бол Q\u003e 0 утга. Хэрэв систем хүрээлэн буй биетүүд дээр эерэг ажил хийвэл A\u003e 0 утга. Хэрэв систем нь хүрээлэн буй биетүүдтэйгээ дулааны солилцоо хийж, (эерэг эсвэл сөрөг) ажил гүйцэтгэдэг бол системийн төлөв өөрчлөгдөж, системийн байдал өөрчлөгдөж, өөрөөр хэлбэл түүний макроскоп параметрүүд (температур, даралт, эзэлхүүн) өөрчлөгддөг. Термодинамик. Термодинамикийн эхний хууль U дотоод энерги нь системийн төлөв байдлыг тодорхойлдог макроскоп параметрүүдээр өвөрмөц байдлаар тодорхойлогддог тул дулаан дамжуулах үйл явц ба ажлын гүйцэтгэл нь системийн дотоод энергийн ΔU-ийн өөрчлөлт дагалддаг.
Термодинамик. Термодинамикийн эхний хууль U дотоод энерги нь системийн төлөв байдлыг тодорхойлдог макроскоп параметрүүдээр өвөрмөц байдлаар тодорхойлогддог тул дулаан дамжуулах үйл явц ба ажлын гүйцэтгэл нь системийн дотоод энергийн ΔU-ийн өөрчлөлт дагалддаг. Термодинамик. Термодинамикийн эхний хууль Термодинамикийн эхний хууль бол термодинамикийн системийн хувьд энерги хадгалагдах, хувирах хуулийн ерөнхий ойлголт юм. Үүнийг дараахь байдлаар томъёолсон болно: Тусгаарлагдаагүй термодинамикийн системийн дотоод энергийн ΔU-ийн өөрчлөлт нь системд шилжүүлсэн Q дулааны хэмжээ ба системийн гадны биетүүд дээр гүйцэтгэсэн А ажлын хоорондох зөрүүтэй тэнцүү байна. ΔU \u003d Q - A Термодинамикийн нэгдүгээр хуулийг илэрхийлсэн харьцааг ихэвчлэн өөр хэлбэрээр бичдэг: Q \u003d ΔU + A Системийн хүлээн авсан дулааны хэмжээг дотоод энергийг нь өөрчлөх, гадны биетүүд дээр ажиллахад ашигладаг.
Термодинамик. Термодинамикийн эхний хууль Термодинамикийн эхний хууль бол термодинамикийн системийн хувьд энерги хадгалагдах, хувирах хуулийн ерөнхий ойлголт юм. Үүнийг дараахь байдлаар томъёолсон болно: Тусгаарлагдаагүй термодинамикийн системийн дотоод энергийн ΔU-ийн өөрчлөлт нь системд шилжүүлсэн Q дулааны хэмжээ ба системийн гадны биетүүд дээр гүйцэтгэсэн А ажлын хоорондох зөрүүтэй тэнцүү байна. ΔU \u003d Q - A Термодинамикийн нэгдүгээр хуулийг илэрхийлсэн харьцааг ихэвчлэн өөр хэлбэрээр бичдэг: Q \u003d ΔU + A Системийн хүлээн авсан дулааны хэмжээг дотоод энергийг нь өөрчлөх, гадны биетүүд дээр ажиллахад ашигладаг. Термодинамик. Термодинамикийн 1-р хууль Термодинамикийн 1-р хуулийг хийн доторх изопроцессуудад хэрэгжүүлье. Изохорик процесст (V \u003d const) хий нь ажиллахгүй, A \u003d 0. Тиймээс Q \u003d ΔU \u003d U (T 2) - U (T 1) болно. Энд U (T 1) ба U (T 2) нь хийн эхний ба эцсийн төлөв дэх дотоод энерги юм. Идеал хийн дотоод энерги нь зөвхөн температураас хамаарна (Жоулын хууль). Изохорик халаалтаар дулааныг хий шингээж (Q\u003e 0), түүний дотоод энерги нэмэгддэг. Хөргөх үед дулааныг гадны биетүүдэд өгдөг (Q 0 - дулааныг хий шингээж авдаг бөгөөд хий нь эерэг ажил хийдэг. Изобарик шахалтын үед Q
Термодинамик. Термодинамикийн 1-р хууль Термодинамикийн 1-р хуулийг хийн доторх изопроцессуудад хэрэгжүүлье. Изохорик процесст (V \u003d const) хий нь ажиллахгүй, A \u003d 0. Тиймээс Q \u003d ΔU \u003d U (T 2) - U (T 1) болно. Энд U (T 1) ба U (T 2) нь хийн эхний ба эцсийн төлөв дэх дотоод энерги юм. Идеал хийн дотоод энерги нь зөвхөн температураас хамаарна (Жоулын хууль). Изохорик халаалтаар дулааныг хий шингээж (Q\u003e 0), түүний дотоод энерги нэмэгддэг. Хөргөх үед дулааныг гадны биетүүдэд өгдөг (Q 0 - дулааныг хий шингээж авдаг бөгөөд хий нь эерэг ажил хийдэг. Изобарик шахалтын үед Q Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Carnot цикл Дулааны хөдөлгүүр нь хүлээн авсан дулааны хэмжээг механик ажилд шилжүүлэх чадвартай төхөөрөмж юм. Дулааны хөдөлгүүрт механик ажил нь ажлын шингэн гэж нэрлэгддэг зарим бодисыг өргөжүүлэх явцад хийгддэг. Хийн бодис (бензиний уур, агаар, усны уур) -ийг ихэвчлэн ажлын шингэн болгон ашигладаг. Ажлын байгууллага нь дотоод энерги ихтэй биетэй дулааны солилцооны явцад дулааны энергийг хүлээн авдаг (эсвэл өгдөг). Эдгээр биеийг дулааны усан сан гэж нэрлэдэг. Үнэхээр одоо байгаа дулааны хөдөлгүүрүүд (уурын хөдөлгүүр, дотоод шаталтат хөдөлгүүр гэх мэт) нь мөчлөгөөр ажилладаг. Дулаан дамжуулах, хүлээн авсан дулааны хэмжээг ажилд шилжүүлэх үйл явц үе үе давтагддаг. Үүний тулд ажлын шингэн нь эхний төлөвийг үе үе сэргээдэг дугуй процесс эсвэл термодинамикийн мөчлөгийг гүйцэтгэх ёстой.
Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Carnot цикл Дулааны хөдөлгүүр нь хүлээн авсан дулааны хэмжээг механик ажилд шилжүүлэх чадвартай төхөөрөмж юм. Дулааны хөдөлгүүрт механик ажил нь ажлын шингэн гэж нэрлэгддэг зарим бодисыг өргөжүүлэх явцад хийгддэг. Хийн бодис (бензиний уур, агаар, усны уур) -ийг ихэвчлэн ажлын шингэн болгон ашигладаг. Ажлын байгууллага нь дотоод энерги ихтэй биетэй дулааны солилцооны явцад дулааны энергийг хүлээн авдаг (эсвэл өгдөг). Эдгээр биеийг дулааны усан сан гэж нэрлэдэг. Үнэхээр одоо байгаа дулааны хөдөлгүүрүүд (уурын хөдөлгүүр, дотоод шаталтат хөдөлгүүр гэх мэт) нь мөчлөгөөр ажилладаг. Дулаан дамжуулах, хүлээн авсан дулааны хэмжээг ажилд шилжүүлэх үйл явц үе үе давтагддаг. Үүний тулд ажлын шингэн нь эхний төлөвийг үе үе сэргээдэг дугуй процесс эсвэл термодинамикийн мөчлөгийг гүйцэтгэх ёстой. Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг Бүх дугуй процессын нийтлэг шинж чанар нь ажлын шингэнийг зөвхөн нэг дулааны усан сантай дулааны холбоо барих замаар гүйцэтгэх боломжгүй юм. Танд дор хаяж хоёр нь хэрэгтэй. Илүү өндөр температуртай дулааны усан санг халаагч, бага температуртай бол хөргөгч гэж нэрлэдэг. Дугуй процесс хийж, ажлын шингэн халаагчаас тодорхой хэмжээний дулааныг Q 1\u003e 0 хүлээн авч хөргөгчинд дулааны дулааны хэмжээг өгдөг.
Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг Бүх дугуй процессын нийтлэг шинж чанар нь ажлын шингэнийг зөвхөн нэг дулааны усан сантай дулааны холбоо барих замаар гүйцэтгэх боломжгүй юм. Танд дор хаяж хоёр нь хэрэгтэй. Илүү өндөр температуртай дулааны усан санг халаагч, бага температуртай бол хөргөгч гэж нэрлэдэг. Дугуй процесс хийж, ажлын шингэн халаагчаас тодорхой хэмжээний дулааныг Q 1\u003e 0 хүлээн авч хөргөгчинд дулааны дулааны хэмжээг өгдөг. Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг Ажлын шингэний нэг мөчлөгт гүйцэтгэсэн А ажил нь нэг мөчлөгт хүлээн авсан дулааны хэмжээтэй тэнцүү байна.А ажлын харьцааг ажлын шингэний халаагчаас цикл тутамд хүлээн авсан дулааны Q 1-ийн хэмжээтэй харьцуулан дулааны хөдөлгүүрийн үр ашиг гэж нэрлэдэг.
Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг Ажлын шингэний нэг мөчлөгт гүйцэтгэсэн А ажил нь нэг мөчлөгт хүлээн авсан дулааны хэмжээтэй тэнцүү байна.А ажлын харьцааг ажлын шингэний халаагчаас цикл тутамд хүлээн авсан дулааны Q 1-ийн хэмжээтэй харьцуулан дулааны хөдөлгүүрийн үр ашиг гэж нэрлэдэг. Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг Үр ашиг нь "халуун" усан сангаас ажлын шингэн хүлээн авсан дулааны энерги хичнээн ашигтай ажил болсныг харуулж байна. Үлдсэн хэсэг нь (1 - η) хөргөгчинд шилжсэн "ашиггүй" байсан. (1 - η) Дулааны хөдөлгүүрийн үр ашиг үргэлж нэгээс бага байдаг (η 0, A\u003e 0, Q 2 T 2
Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг Үр ашиг нь "халуун" усан сангаас ажлын шингэн хүлээн авсан дулааны энерги хичнээн ашигтай ажил болсныг харуулж байна. Үлдсэн хэсэг нь (1 - η) хөргөгчинд шилжсэн "ашиггүй" байсан. (1 - η) Дулааны хөдөлгүүрийн үр ашиг үргэлж нэгээс бага байдаг (η 0, A\u003e 0, Q 2 T 2 Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг 1824 онд Францын инженер С.Карно хоёр изотерм ба хоёр адиабатаас бүрдэх дугуй процессыг авч үзсэн нь дулааны процессын онолыг боловсруулахад чухал үүрэг гүйцэтгэв. Үүнийг Карногийн мөчлөг гэж нэрлэдэг (Зураг 3. 11. 4).
Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Карногийн мөчлөг 1824 онд Францын инженер С.Карно хоёр изотерм ба хоёр адиабатаас бүрдэх дугуй процессыг авч үзсэн нь дулааны процессын онолыг боловсруулахад чухал үүрэг гүйцэтгэв. Үүнийг Карногийн мөчлөг гэж нэрлэдэг (Зураг 3. 11. 4). Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Carnot Cycle Carnot Cycle нь поршений доор байгаа цилиндрт хий үүсгэдэг. Изотермийн хэсэгт (1-2) хий нь T температуртай халуун дулаан усан сан (халаагч) -тай дулааны холбоонд ордог бөгөөд хий нь изотерм байдлаар өргөжиж, А 12 ажлыг гүйцэтгэдэг бол тодорхой хэмжээний дулааныг Q 1 \u003d A 12 хийд нийлүүлдэг. адиабатик хэсэгт (2-3) хий нь адиабат бүрхүүлд байрладаг ба дулаан дамжуулалтгүй нөхцөлд үргэлжлүүлэн тэлсээр байдаг. Энэ хэсэгт хий нь A 23\u003e 0. ажлыг гүйцэтгэдэг. Адиабатик тэлэлтийн үеийн хийн температур T 2 утга хүртэл буурдаг. Дараагийн изотермийн хэсэгт (3-4) хийнийг T 2 температурт хүйтэн дулааны усан сан (хөргөгч) -тэй дулааны холбоонд оруулна.
Дулааны хөдөлгүүр. Термодинамикийн мөчлөг. Carnot Cycle Carnot Cycle нь поршений доор байгаа цилиндрт хий үүсгэдэг. Изотермийн хэсэгт (1-2) хий нь T температуртай халуун дулаан усан сан (халаагч) -тай дулааны холбоонд ордог бөгөөд хий нь изотерм байдлаар өргөжиж, А 12 ажлыг гүйцэтгэдэг бол тодорхой хэмжээний дулааныг Q 1 \u003d A 12 хийд нийлүүлдэг. адиабатик хэсэгт (2-3) хий нь адиабат бүрхүүлд байрладаг ба дулаан дамжуулалтгүй нөхцөлд үргэлжлүүлэн тэлсээр байдаг. Энэ хэсэгт хий нь A 23\u003e 0. ажлыг гүйцэтгэдэг. Адиабатик тэлэлтийн үеийн хийн температур T 2 утга хүртэл буурдаг. Дараагийн изотермийн хэсэгт (3-4) хийнийг T 2 температурт хүйтэн дулааны усан сан (хөргөгч) -тэй дулааны холбоонд оруулна.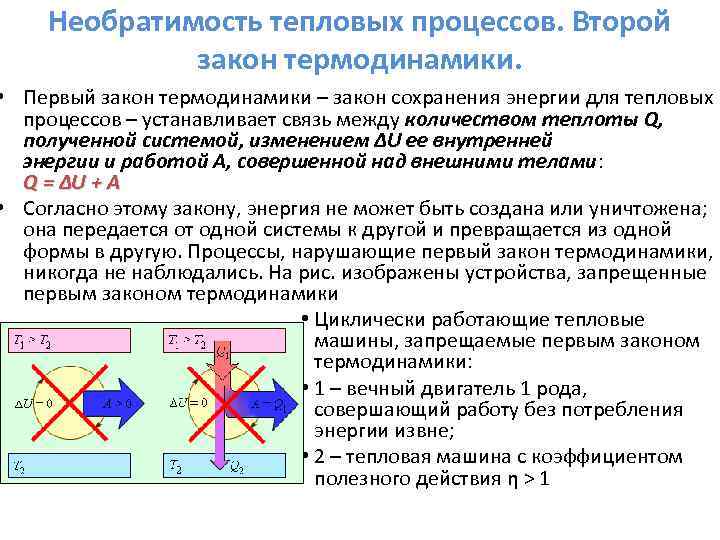 Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Термодинамикийн эхний хууль - дулааны процесст зориулагдсан энергийг хадгалах хууль - системд хүлээн авсан дулааны хэмжээ Q, түүний дотоод энергийн ΔU өөрчлөлт ба гадны биетүүд дээр хийсэн А ажлын хоорондох холбоог тогтоодог: Q \u003d ΔU + A Энэ хуулийн дагуу энерги үүсгэх боломжгүй эсвэл устгасан; энэ нь нэг системээс нөгөөд шилжиж нэг хэлбэрээс нөгөө хэлбэрт шилждэг. Термодинамикийн нэгдүгээр хуулийг зөрчсөн үйл явц хэзээ ч ажиглагдаж байгаагүй. Зураг дээр. Термодинамикийн нэгдүгээр хуулиар хориглосон төхөөрөмжүүдийг дүрслэв.Термодинамикийн нэгдүгээр хуулиар хориглосон мөчлөгт ажилладаг дулааны хөдөлгүүрүүд: 1 - гаднаас энерги зарцуулахгүйгээр ажил гүйцэтгэдэг, анхны төрлийн байнгын хөдөлгөөнт машин; 2 - үр ашигтай engine\u003e 1 дулааны хөдөлгүүр
Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Термодинамикийн эхний хууль - дулааны процесст зориулагдсан энергийг хадгалах хууль - системд хүлээн авсан дулааны хэмжээ Q, түүний дотоод энергийн ΔU өөрчлөлт ба гадны биетүүд дээр хийсэн А ажлын хоорондох холбоог тогтоодог: Q \u003d ΔU + A Энэ хуулийн дагуу энерги үүсгэх боломжгүй эсвэл устгасан; энэ нь нэг системээс нөгөөд шилжиж нэг хэлбэрээс нөгөө хэлбэрт шилждэг. Термодинамикийн нэгдүгээр хуулийг зөрчсөн үйл явц хэзээ ч ажиглагдаж байгаагүй. Зураг дээр. Термодинамикийн нэгдүгээр хуулиар хориглосон төхөөрөмжүүдийг дүрслэв.Термодинамикийн нэгдүгээр хуулиар хориглосон мөчлөгт ажилладаг дулааны хөдөлгүүрүүд: 1 - гаднаас энерги зарцуулахгүйгээр ажил гүйцэтгэдэг, анхны төрлийн байнгын хөдөлгөөнт машин; 2 - үр ашигтай engine\u003e 1 дулааны хөдөлгүүр Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Термодинамикийн нэгдүгээр хууль нь дулааны процессын чиглэлийг тогтоодоггүй.Процессийн термодинамикийн нэгдүгээр хууль. Гэсэн хэдий ч туршлагаас харахад олон дулааны процессууд зөвхөн нэг чиглэлд явагдах боломжтой. Ийм үйл явцыг эргэлт буцалтгүй гэж нэрлэдэг. Жишээлбэл, өөр өөр температуртай хоёр биений дулааны холбоо барих үед дулааны урсгал нь үргэлж дулаан биеэс хүйтэн бие рүү чиглүүлдэг. Бага температуртай биетээс өндөр температурт бие махбодид аяндаа дулаан дамжуулалт хэзээ ч байдаггүй. Үүний үр дүнд хязгаарлагдмал температурын зөрүү дэх дулаан дамжуулах үйл явц нь эргэлт буцалтгүй юм. Буцаах үйл явц гэдэг нь системийн тэнцвэрийн төлөв байдлаас нөгөө тэнцвэрт байдалд шилжих үйл явц бөгөөд үүнийг завсрын тэнцвэрийн ижил дарааллаар эсрэг чиглэлд гүйцэтгэж болох үйл явц юм. Энэ тохиолдолд систем өөрөө болон хүрээлэн буй бие нь анхны байдалдаа эргэж ирдэг. Систем үргэлж тэнцвэртэй байх процессуудыг бараг статик гэж нэрлэдэг. Бүх хагас статик процессууд буцаагдах боломжтой. Бүх буцах процессууд нь бараг статик байдаг.
Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Термодинамикийн нэгдүгээр хууль нь дулааны процессын чиглэлийг тогтоодоггүй.Процессийн термодинамикийн нэгдүгээр хууль. Гэсэн хэдий ч туршлагаас харахад олон дулааны процессууд зөвхөн нэг чиглэлд явагдах боломжтой. Ийм үйл явцыг эргэлт буцалтгүй гэж нэрлэдэг. Жишээлбэл, өөр өөр температуртай хоёр биений дулааны холбоо барих үед дулааны урсгал нь үргэлж дулаан биеэс хүйтэн бие рүү чиглүүлдэг. Бага температуртай биетээс өндөр температурт бие махбодид аяндаа дулаан дамжуулалт хэзээ ч байдаггүй. Үүний үр дүнд хязгаарлагдмал температурын зөрүү дэх дулаан дамжуулах үйл явц нь эргэлт буцалтгүй юм. Буцаах үйл явц гэдэг нь системийн тэнцвэрийн төлөв байдлаас нөгөө тэнцвэрт байдалд шилжих үйл явц бөгөөд үүнийг завсрын тэнцвэрийн ижил дарааллаар эсрэг чиглэлд гүйцэтгэж болох үйл явц юм. Энэ тохиолдолд систем өөрөө болон хүрээлэн буй бие нь анхны байдалдаа эргэж ирдэг. Систем үргэлж тэнцвэртэй байх процессуудыг бараг статик гэж нэрлэдэг. Бүх хагас статик процессууд буцаагдах боломжтой. Бүх буцах процессууд нь бараг статик байдаг. Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Механик ажлын бие махбодийн дотоод энерги болж хувирах процессууд нь үрэлт, хий ба шингэн дэхь диффузийн процесс, даралтын анхны зөрүүтэй үед хий холих процесс гэх мэт эргэлт буцалтгүй байдаг. үйл явц. Буцаах үйл явц нь бодит үйл явцыг төгс төгөлдөржүүлэх явдал юм. Термодинамикийн эхний хууль нь эргэлт буцалтгүй процессоос ялгах боломжгүй юм. Энэ нь ердөө л термодинамик процессоос тодорхой энергийн балансыг шаарддаг бөгөөд ийм процесс боломжтой эсэх талаар юу ч хэлдэггүй.
Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Механик ажлын бие махбодийн дотоод энерги болж хувирах процессууд нь үрэлт, хий ба шингэн дэхь диффузийн процесс, даралтын анхны зөрүүтэй үед хий холих процесс гэх мэт эргэлт буцалтгүй байдаг. үйл явц. Буцаах үйл явц нь бодит үйл явцыг төгс төгөлдөржүүлэх явдал юм. Термодинамикийн эхний хууль нь эргэлт буцалтгүй процессоос ялгах боломжгүй юм. Энэ нь ердөө л термодинамик процессоос тодорхой энергийн балансыг шаарддаг бөгөөд ийм процесс боломжтой эсэх талаар юу ч хэлдэггүй. Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Аяндаа үүсэх үйл явцын чиглэлийг термодинамикийн хоёрдугаар хуулиар тогтоодог. Үүнийг термодинамикт тодорхой төрлийн термодинамик процесст хориг тавих хэлбэрээр томъёолж болно. Английн физикч В.Келвин 1851 онд хоёрдахь хуулийн дараахь томъёоллыг өгсөн: Хоёр дахь хууль Циклийн горимд ажилладаг дулааны хөдөлгүүрт процесс явагдах боломжгүй бөгөөд үүний цорын ганц үр дүн нь нэг дулааны усан сангаас хүлээн авсан дулааны бүхэл бүтэн хэмжээг механик ажил болгон хувиргах явдал юм.
Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Аяндаа үүсэх үйл явцын чиглэлийг термодинамикийн хоёрдугаар хуулиар тогтоодог. Үүнийг термодинамикт тодорхой төрлийн термодинамик процесст хориг тавих хэлбэрээр томъёолж болно. Английн физикч В.Келвин 1851 онд хоёрдахь хуулийн дараахь томъёоллыг өгсөн: Хоёр дахь хууль Циклийн горимд ажилладаг дулааны хөдөлгүүрт процесс явагдах боломжгүй бөгөөд үүний цорын ганц үр дүн нь нэг дулааны усан сангаас хүлээн авсан дулааны бүхэл бүтэн хэмжээг механик ажил болгон хувиргах явдал юм. Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Германы физикч Р.Клаузиус термодинамикийн хоёрдахь хуулийн өөр нэг томъёоллыг гаргажээ: Процесс боломжгүй бөгөөд цорын ганц үр дүн нь бага температуртай биеэс өндөр температуртай биет рүү дулаан солилцоогоор энерги дамжуулах явдал юм. Зураг дээр. хоёрдугаар хуулиар хориглосон боловч термодинамикийн нэгдүгээр хуулиар хориглоогүй үйл явцыг дүрслэв. Эдгээр процессууд нь термодинамикийн хоёр дахь хуулийн хоёр томъёололд нийцдэг. 1 - хоёр дахь төрлийн байнгын хөдөлгөөнт машин; 2 - хүйтэн биеэс дулаан бие рүү дулааны аяндаа шилжих (хамгийн тохиромжтой хөргөгч машин)
Дулааны процессын эргэлт буцалтгүй байдал. Термодинамикийн хоёрдахь хууль. Германы физикч Р.Клаузиус термодинамикийн хоёрдахь хуулийн өөр нэг томъёоллыг гаргажээ: Процесс боломжгүй бөгөөд цорын ганц үр дүн нь бага температуртай биеэс өндөр температуртай биет рүү дулаан солилцоогоор энерги дамжуулах явдал юм. Зураг дээр. хоёрдугаар хуулиар хориглосон боловч термодинамикийн нэгдүгээр хуулиар хориглоогүй үйл явцыг дүрслэв. Эдгээр процессууд нь термодинамикийн хоёр дахь хуулийн хоёр томъёололд нийцдэг. 1 - хоёр дахь төрлийн байнгын хөдөлгөөнт машин; 2 - хүйтэн биеэс дулаан бие рүү дулааны аяндаа шилжих (хамгийн тохиромжтой хөргөгч машин)

 орц
орц